§ 21. Електрична взаємодія атомів у кристалічних тілах
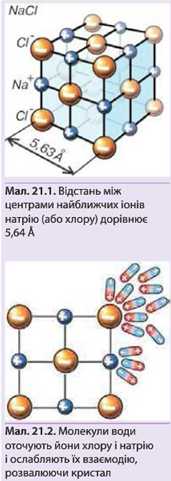
Іонні кристали
Типовим прикладом іонного кристала є кристал кухонної солі (NaCI). Його кристалічна ґратка складається з кубічних елементарних комірок, у яких чергуються іони натрію і хлору (мал. 21.1). Атом Хлору перетягує до себе один електрон від Натрію і стає негативно зарядженим йоном (сумарний його заряд дорівнює -е). Атом Натрію, втративши електрон, перетворюється на позитивно заряджений йон (сумарний його заряд дорівнює +е).
Взаємне притягання протилежно заряджених іонів створює іонний зв'язок. Міцність кристаликів кухонної солі пояснюється саме силою електричного притягання іонів натрію і хлору. З енергетичних міркувань ця взаємодія вигідна, оскільки загальна потенціальна енергія всіх атомів ґратки зменшується, а стійкість структури зростає.Іонні кристали слабко розширюються при нагріванні і мають порівняно високу температуру плавлення. Це означає, що іонний зв'язок дуже міцний. Кухонна сіль плавиться при температурі 800°С. У кристалі негашеного вапна (CaO7 Ca - кальцій) йони двовалентні, тобто вони мають подвоєний елементарний заряд 2е. В такому кристалі іони сильніше взаємодіють і температура плавлення у нього вища за 2 OOO0C. При розчиненні іонний кристал розпадається на йони, а при випаровуванні - на молекули (рідше - на атоми чи йони). В розплавленому стані йонний кристал також розпадається на йони.
Чому сіль розчиняється у воді
Поляризовані молекули води оточують йони речовини, притягуючись до них протилежним полюсом (мал. 21.2а). Цим вони сильно послаблюють взає-
модію іонів між собою (у 81 раз). Решта молекул води, яким не вдалося добратися до йо-нів, штовхають у тепловому русі своїх більш вдалих сусідів і допомагають їм розхитувати кристалічну ґратку. В результаті молекули води буквально «розвалюють» кристал шар за шаром на складові частини, тобто на йони (мал. 21.26). Водночас у перенасиченому розчині починається спонтанний (самовільний) ріст кристалів на «затравках».
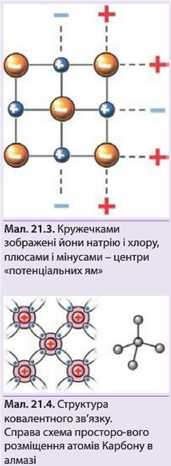
Як росте кристал солі в насиченому
розчині
Розглянемо плоску модель процесу росту кристала солі (мал. 21.3). Кружечками зображені йони натрію і хлору, плюсами і мінусами - центри «потенціальних ям», утворених електричними полями сусідніх йонів. Йони, які «плавають» у розчині, потрапивши в «яму», залишаються в ній, утворюючи наступний шар кристалічної ґратки. Одні «ями» розраховані на позитивні іони, і тільки вони можуть туди «попастися», інші - на негативні. За знаком зарядів (на малюнку), сусідніх з «ямами» йонів, можна легко здогадатися, де які «ями» знаходяться.
Ковалентний зв'язок
Атомарні кристали утворюються, коли сусідні атоми об'єднують кілька своїх електронів з останньої електронної оболонки (вона називається валентною). Це дуже міцний хімічний зв'язок, який називають ковалентним (або гомеополярним). На малюнку21.4 схематично показано, як при такому зв'язку утримуються атоми Карбону в кристалічній ґратці алмазу. Кожний атом Карбону в кристалі алмазу має чотири найближчих сусіди. У цьому випадку задіяні всі чотири валентні електрони зовнішньої електронної оболонки.
Електронна провідність металів
Кристали металів складаються з каркасів позитивно заряджених йонів, серед яких хаотично і вільно рухаються електрони. Атоми металу віддають у «загальне користування» електрони останніх електронних оболонок. Ці елек-
трони називають вільними, на відміну від електронів внутрішніх оболонок, які не покидають атом. Вільні електрони рухаються по всьому кристалу і утворюють так званий «електронний газ». Завдяки цьому метали мають дуже добрі теплопровідність і електропровідність. Вони міцні, непрозорі, добре відбивають світло і тому мають характерний «металічний» блиск.
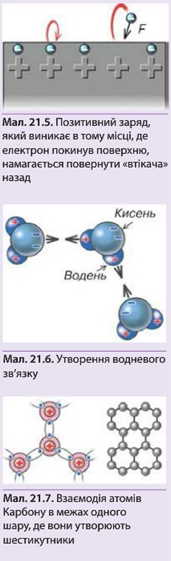
Чому електрони не покидають поверхні металу
Для вільних електронів на поверхні металу існує можливість вилетіти за поверхню кристала. Чому ж таке не відбувається масово? В тому місці, де електрон покидає поверхню металу, утворюється надлишковий позитивний заряд +е (мол. 21.5) через що виникає сила притягання, яка перешкоджає виходу електрона. Для того щоб вилетіти з кристала, даний електрон повинен мати кінетичну енергію, значно більшу за середню. Він повинен виконати певну роботу, яка називається роботою виходу. При звичайних температурах таких електронів дуже мало. Якщо ж метал нагріти, то їх стане більше.
Водневий зв'язок
Атом Гідрогену малий і якщо він знаходиться між двома іншими атомами, то притягується одночасно до них обох, зв'язуючи їх в єдину структуру (мал. 21.6). Позитивно заряджене ядро атома Гідрогену зміщується до одного атома, а електрон - до іншого. Довжина зв'язку O-H ~1 А (для порівняння: відстань між ядрами H-H = і ,5 А).
Особливість взаємодії в кристалі
графіту
У багатьох випадках у кристалі діють одночасно кілька видів зв'язку. З цієї точки зору дуже цікавим є графіт, який має шарувату структуру (мол. 21.7). В межах одного шару три електрони зовнішньої електронної оболонки атома Карбону утворюють ковалент-
ний зв'язок із трьома найближчими сусідами. Один електрон залишається вільним, як у металів (тому графіт може проводити струм). Між шарами діють слабші молекулярні сили.
ТВОРЧЕ ЗАВДАННЯ
21.1. Дізнайтеся більше про молекулярний зв>язок (сили Ван-дер-Ваальса). Як утворюється молекулярний зв'язок і в яких речовинах?
ЗАВДАННЯ ДЛЯ ДОСЛІДЖЕННЯ
21.1. В йонних кристалах притягуються іони протилежних знаків. Чому ж вони не зближаються ще більше, на відстань, яка менша від рівноважної відстані г0?
21.2. Сіль добре розчиняється у воді. Коли ж солі дуже багато, вона більше не розчиняється, тобто розчин стає перенасиченим. Знайти причину, за якоїненасичений розчин стає насиченим.
21.3. Дослідіть, як залежить температура кристалізації солоної води від концентрації солі. Концентрацію вимірюють у грамах солі на 100 грамів води.
КОРОТКІ висновки
З Структура, міцність, температура плавлення і багато інших характеристик твердих тіл визначаються тими різновидами електричних сил, які зв'язують атоми.
ВПРАВА №21
1. Назвіть різні типи кристалів і зв'язків між атомами (молекулами).
2. Як іони натрію і хлору в розчині знаходять «свої» місця під час росту кристала? Де знаходяться ці місця?
3. Чому при синтезі алмазу графіт треба не тільки сильно стиснути, а й нагріти?
4. Які електрони утворюють ковалентний зв'язок?
5. Чому метали проводять струм?
6. Чому проводить струм графіт?
7. Чому алмаз міцніший від графіту?
8. Чому алмаз не проводить струму?
9. Якого типу зв'язки діють у кристалі льоду?
10. Чим відрізняється структура кристалічних ґраток: а)льоду і кухонної солі; б)графіту й алмазу?
11. Чому при випаровуванні з поверхні іонного кристала вилітають молекули, а не іони?
12. Як впливає валентність іонів О’хній заряд) на властивості іонних кристалів?
13. Як впливає валентність іонів, що утворюють кристал, на його розчинність?
14. Чому електрони покидають поверхню металу тільки при високій температурі?
ІСТОРІЯ ВІДКРИТТЯ ЗАКОНУ взаємодії електричних
ЗАРЯДІВ: КАВЄНДІШ І КУЛОН
Закон взаємодії електричних зарядів - закон Кулона відкритий у 1785 р. французьким військовим інженером і фізиком Шарлем Огюстеном Кулоном. Але історія згаданого відкриття почалася раніше.
Першим закон взаємодії електричних зарядів експериментально установив видатний англійський учений лорд Генрі Кавендіш. Про більшість відкриттів Кавендіша світ дізнався лише після його смерті, коли інший великий учений Джеймс Клерк Максвелл опублікував книгу «Електричні дослідження високоповажного Генрі Кавендіша».

Генрі народився 1731 р. у багатій сім'ї', яка належала до знатного роду герцогів Девонширських. Із 1749 р. він навчався в коледжі Кембриджського університету, але після завершення навчання він не наважився складати випускні іспити і тому не отримав ученого ступеня.
Генрі Кавендіш дуже багато зробив для науки, зокрема дослідив теплове розширення тіл; встановив, що процеси плавлення і кипіння відбуваються при сталій температурі; вивчав вплив температури на протікання хімічних реакцій; відкрив водень і вуглекислий газ; установив хімічний склад повітря та води; обчислив значення сталої всесвітнього тяжіння та середню густину Землі. У 1760 р. Генрі Кавендіш став членом Лондонського королівського товариства. Цей видатний учений був дуже багатою людиною, заняття хімією і фізикою було для нього пристрасним захопленням. Він рідко публікував результати своїх досліджень, а праці з електрики не опубліковував зовсім. Близько 100 років його праці з електрики пролежали в сімейному архіві. Нарешті, вони потрапили до рук Максвелла, який затратив шість років на їх вивчення і публікацію. Але закон взаємодії зарядів на той час уже був відкритий і увійшов в історію як закон Кулона. Крім закону взаємодії електричних зарядів, Кавендіш вивчав також електричну ємність провідників; досліджував електричних риб; створив «штучного електричного ската»; задовго до Ома вивчав провідність різних матеріалів. Отже, у своїх дослідженнях з електрики Кавендіш значно випередив час. Його іменем названа одна з найзнаменитіших лабораторій світу «Кавендішську фізичну лабораторію», гроші на створення якої виділили нащадки сім'ї' Кавендіша.
Шарль Огюстен Кулон народився 1736 р. у Франції, в сім'ї' військового. Він здобув добру початкову освіту в коледжі. Батьки, а особливо мати, хотіли, щоб Шарль став медиком, але він всупереч їхній волі вступив до військово-інженерної школи, найкращого вищого технічного навчального закладу того часу.
Тут Кулон здобув досить добру математичну підготовку. Після закінчення школи він став військовим інженером і 8 років будував військові укріплення на острові Мартініка, який був колонією Франції. У вільний час займався науковими дослідженнями. Академія наук призначає його в комісію з реформи мір і ваги. Широта інтересів сприяла проведенню наукових досліджень у різних галузях. Він шукає найкращий спосіб виготовлення магнітних стрілок для компасів, досліджує оптимальну форму лопастей вітряків, конструює дуже чутливий прилад для вимірювання магнітного поля Землі. В основу цього приладу він поклав крутильні терези. При цьому дослідник досить детально вивчає, як закручуються тонкі нитки з різних матеріалів. Саме вдосконалюючи свої крутильні терези, він відкрив закон взаємодії точкових зарядів.

Відкриттю Кулона сприяла та обставина, що сила взаємодії між електричними зарядами велика порівняно із силою гравітаційної взаємодії. Тому йому не треба було дуже чутливої апаратури. Крутильні терези - це звичайна дерев'яна паличка-коромисло, підвішена на тонкій пружній нитці (мал. 21.8а). На одному кінці коромисла закріплена металева кулька (мал. 21.86), а на другому - противага, щоб паличка перебувала в горизонтальній площині. Ще одна кулька розміщалася нерухомо на терезах (мал. 21.8в). Кульки заряджалися і сила взаємодії вимірювалася за кутом закручення дротини, який фіксував світловий «зайчик» на шкалі. Значення заряду на кульці Кулон зменшував, торкаючись до неї такою самою, але незарядженою кулькою. Заряд перерозподілявся порівну між двома однаковими кульками, зменшуючись на зарядженій кульці вдвічі.
Змінюючи у такий спосіб заряди на кульках та вимірюючи відстані між центрами кульок і силу, яка закручувала дротину, Кулон відкрив свій знаменитий
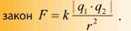
Зауважимо, що для відкриття середньої густини Землі і сталої всесвітнього тяжіння Кавендіш також використовував крутильні терези, причому його досліди потребували значно більшої точності, ніж досліди Кулона - необхідна чутливість становила (в сучасних одиницях) одну мільярдну ньютона. Але Кулон не знав ні про крутильні терези Кавендіша, ні про його експерименти.
Після відкриття закону взаємодії зарядів, Кулон вивчав розподіл зарядів на поверхні провідників різних форм, досліджував магнітні сили. Всі основні його праці з електрики і магнетизму були завершені до 1789 р., тобто до Великої французької революції. Будучи офіцером королівської армії, Кулон побоювався, що революційний терор не обмине і його. Тому він іде у відставку і поселяється у своєму маєтку в провінції. Там він уже не міг проводити досліди з електрики і змінив тематику досліджень. Кулон вивчає циркуляцію соку в деревах, вимірює ефективність м'язових зусиль людини. До Парижа він повернувся тільки 1797 р. і до кінця життя займався викладацькою діяльністю, водночас проводячи наукові дослідження.
Цей матеріал з підручника Фізика 8 клас Пшенічка
Автор: evg от 11-08-2016, 14:20, Переглядів: 1406