§ 10. Плавлення і твердіння кристалічних речовин
В яких агрегатних станах може перебувати речовина?
Яка будова кристалічних тіл і рідин?
Ви добре знаєте, що одна і та ж речовина може перебувати в трьох агрегатних станах: у твердому, рідкому і газоподібному. Ці стани речовини розрізняються розташуванням, характером руху і взаємодії молекул.
При деяких умовах, наприклад, при певних значеннях температури і тиску, речовини можуть переходити з одною агрегатного етану в інший. Так, метал при відповідній температурі може плавитися, тобто ставати рідким, при зниженні температури знову переходити в твердий стан; ефір легко випаровується, тобто переходить в газоподібний етан навіть при кімнатній температурі. Переходи речовини з одного агрегатного стану в інший називають агрегатними перетвореннями.
Розглянемо процес перетворення речовини з твердою стану в рідкий. Для цього виконаємо дослід. У внутрішню посудину калориметра покладемо трохи подрібненою льоду при температурі -10 °С, опустимо в неї термометр і залишимо на столі. Будемо стежити за зміною температури льоду і процесами, які з ним відбуваються. Спостереження показують, що якийсь час лід залишається в твердому стані і його температура поступово підвищується.
При температурі О °С лід починає плавитися, в посудині з’являється вода, а температура льоду залишається незмінною до тих пір, поки він повністю не перейде в рідкий стан. Після цього температура води, що утворилася з льоду, починає підвищуватися, і це буде відбуватися до тих пір, поки вона не дорівнюватиме кімнатній.
Таким чином, ми спостерігали перехід льоду з твердого етану в рідкий.
Перехід речовини з твердого стану в рідкий називають плавленням.
Зі спостережень випливає, по-перше, що лід починає плавитися при певній температурі. Важливо відзначити, що лід знаходиться в кристалічному стані. Отже, процес плавлення кристалічних тіл відбувається при певній температурі, яку називають температурою плавлення.
По-друге: температура льоду і води, що утворилася, під час усього процесу плавлення залишається незмінною. Таким чином, під час процесу плавлення кристалічної речовини температура речовини залишається сталою.
Лід брав участь в теплообміні з навколишнім повітрям і посудиною KajiopHMerTpa. Отримуючи від них деяку кількість теплоти, лід нагрівався до температури O °С, його внутрішня енергія збільшувалася за рахунок збільшення середньої KiHerTHHHoi енергії теплового руху його частинок.
Потім лід плавився, і його температура при цьому не змінювалася, але лід отримував деяку кількість теплоти. Отже, його внутрішня енергія збільшувалася, але не за рахунок кінетичної, а за рахунок потенціальної енергії взаємодії частинок. Отримана ззовні енергія витрачалася на руйнування кристалічної ґратки.
Процес плавлення кристалічних тіл відбувається аналогічно до розглянутого процесу плавлення льоду. Щоб розплавити тверде кристалічне тіло, необхідно нагріти його до температури плавлення і надалі надавати йому енергію до тих пір, поки воно усе не перетвориться в рідину. Виняток становлять ті речовини, які змінюють свій хімічний склад або відразу перетворюються в газ.
Різні кристалічні речовини мають різну температуру плавлення (табл. 5).
Температура плавлення деяких речовин, °С (за нормального атмосферного тиску)
Таблиця 5
|
Речовина |
г, °С |
Речовина |
Ц °С |
|
Водень |
-259 |
Алюміній |
660 |
|
Кисень |
-219 |
Срібло |
962 |
|
Азот |
-210 |
Золото |
1064 |
|
Спирт |
-114 |
Мідь |
1085 |
|
Ртуть |
-39 |
Чавун |
1200 |
|
ЛІД |
0 |
Сталь |
1500 |
|
Цезій |
29 |
Залізо |
1539 |
|
Натрій |
98 |
Платина |
1772 |
|
Олово |
232 |
Осмій |
3045 |
|
Свинець |
327 |
Вольфрам |
3387 |
|
Цинк |
420 |
Якщо винести посудину з водою на вулицю в зимовий час, то через деякий час вода перетвориться в лід.
Процес переходу речовини з рідкого стану в твердий називають кристалізацією.
У розглянутому прикладі вода спочатку буде охолоджуватися до 0 °С, віддаючи при цьому деяку кількість теплоти навколишньому повітрю. При цьому буде зменшуватися її внутрішня енергія за рахунок зменшення середньої кінетичної енергії руху частинок. Коли температура води стане рівною 0 °С, вона почне перетворюватися в лід. При цьому температура води не буде змінюватися до тих пір, поки вся вона не перейде в твердий стан. Цей процес супроводжується виділенням певної кількості теплоти і відповідно зменшенням внутрішньої енергії води за рахунок зменшення потенціальної енергії взаємодії її частинок.
Таким чином, перехід речовини з рідкого стану в твердий кристалічний відбувається за певної температури, яка називається температурою кристалізації. Ця температура залишається незмінною під час усього процесу кристалізації.
Дослід показує, що для кристалічних тіл температура кристалізації дорівнює температурі плавлення.
Аморфне тіло переходить в рідкий етан не за певної фіксованої температури, а в певному інтервалі температур. Тому більш правильно говорити не про плавлення аморфних тіл, а про розм’якшення їх. Це відбувається тому, що, на відміну від частинок кристалічних тіл, частинки аморфних тіл переміщаються одна відносно одної. При нагріванні їхня швидкість збільшується, збільшуються відстані між ними, тіло поступово розм’якшується і стає текучим.
При охолодженні зменшуються швидкості руху частинок і відстані між ними. Ростуть сили взаємодії між частинками. Тіла втрачають плинність, стають густішими, а потім тверднуть.
Різні кристалічні речовини мають різну будову, різні кристалічні ґратки. Відповідно, для того щоб її зруйнувати за температури плавлення, необхідно затратиш різну енергію, надати речовині різну кількість теплоти.
Питома теплота плавлення — це фізина величина, яка дорівнює кількості теплоти, необхідної для перетворення 1 кг кристалічної речовини при температурі плавлення в рідину тієї ж температури.
Дослід показує, що питома теплота плавлення дорівнює питомій теплоті кристалізації.
Питому тепл ту плавлення позначають літерою λ. Її одиниця — джоуль на кілограм (1 Дж/кг).
Різні речовини мають різну питому теплоту плавлення (табл. 6).
Питома теплота плавлення деяких речовин, Дж/кг
(за температури плавлення і нормального атмосферного тиску)
Таблиця 6
|
Речовина |
 |
Речовина |
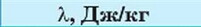 |
|
Алюміній |
3,9 -KP |
Сталь |
0,84 IO5 |
|
Лід |
3,4 10’ |
Золото |
0,6710е |
|
Залізо |
2,7 IO5 |
Водень |
0,59 IO5 |
|
Мідь |
2,110е |
Олово |
0,59 -IO5 |
|
Цинк |
1,12 -IO5 |
Свинець |
0,25 -IO5 |
|
Спирт |
1,110е |
Кисень |
0,14 -IO5 |
|
Срібло |
0,87 -IO5 |
Рт^ть |
0,12-IO5 |
З таблиці видно, що лід має порівняно велику питому теплоту плавлення і кристалізації. Завдяки цьому процес танення снігу і льоду відбувається навесні досить повільно, що дозволяє уникнути великих паводків і сприяє тому, що ґрунт просочується вологою.
Наприклад, питома теплота плавлення свинцю 0,25 · IO5 Дж/кг.
Це означає, що для перетворення 1 кг свинцю з твердого стану в рідкий за температури плавлення необхідно затратити кількість теплоти 0,25 · IO5 Дж. Цьому ж значенню дорівнює збільшення внутрішньої енергії 1 кг свинцю.
Питома теплота плавлення показує, на скільки змінюється внутрішня енергія речовини з масою 1 кг, узятої за температури плавлення, при її плавленні або кристалізації.
Можна сказати, що при переході 1 кг свинцю з рідкого стану в твердий за температури кристалізації виділяється кількість теплоти 0,25 · IO5 Дж. Цьому ж значенню дорівнює зменшення його внутрішньої енергії.
Якщо відома кількість теплоти, яка необхідна для плавлення 1 кг, наприклад, свинцю (питома теплота плавлення 0,25 IO5 Дж/кг) за температури плавлення, то для плавлення 5 кг свинцю потрібно затратити кількість теплоти в 5 разів більшу, тобто 1,25 IO5 Дж.
Таким чином, щоб обчислити кількість теплоти Q, необхідну для плавлення речовини з масою т, узятої за температури плавлення, слід питому теплоту плавлення λ помножити на масу речовини:
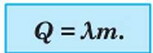
Ця ж формула використовується при обчисленні кількості теплоти, що виділяється при кристалізації рідини.
Процеси плавлення та тверднення можна зобразити графічно. Для цього вздовж вертикальної осі відкладають значення температури речовини, а вздовж горизонтальної — час нагрівання або охолодження. На рис. 26 зображено графік залежності температури льоду та води при нагрівання та охолодженні.
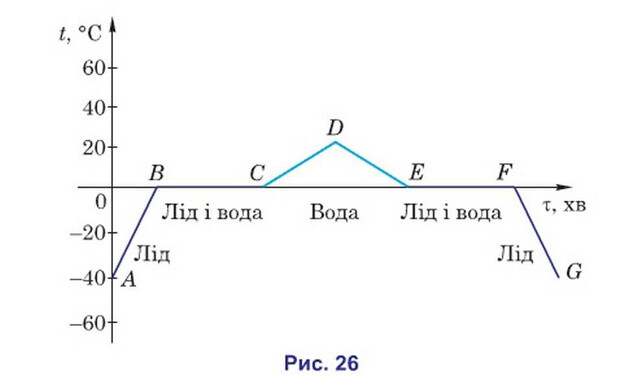
В початковий момент е лід за температури -40 uC (точка А). В процесі нагрівання температура льоду зростає (ділянка АВ) до тих пір поки лід не нагріється до температури плавлення. Кут нахилу ділянки AB визначається питомою теплоємністю речовини.
Після досягнення температури 0 uC лід почне плавитися. Процес плавлення льоду буде відбуватися при сталій температурі (ділянка ВС). Енергія, яка надходить від нагрівника, йде на збільшення потенціальної енергії молекул. Відбувається руйнування кристалічної ґратки льоду. Точка C відповідає стану, коли весь лід розплавився і перетворився на воду. Ділянка CD відповідає процесу нагрівання води. Нахил ділянки CD менший за нахил ділянки АВ, оскільки питома теплоємність води більша за питому теплоємність льоду.
Якщо відключити нагрівник (точка D) то зростання температури води припиниться. Помістимо воду у морозильну камеру, вода почне охолоджуватися (ділянка DE). Коли температура води досягне 0 °С вода почне перетворюватися на лід. Ділянка EF відповідає процесу кристалізації за сталої температури. Після того як вся вода нерєгвориться на лід (точка F) температура льоду знову почне знижуватися (ділянка FG), що відповідає процесу охолодження льоду.
Приклад розв’язування задачі.
Яка кількість теплоти необхідна для плавлення 1 т залізного металобрухту, якщо температура в цеху, де він знаходиться, дорівнює 35 °С?

Розв ’язання.
Для того, щоб розплавити залізо, що знаходиться за температури 35 0C його спочатку потрібно нагріти до температури плавлення 1539 °С і потім розплавити. Втратами енергії на нагрівання навколишнього повітря знехтуємо.
Кількість теплоти, необхідна для нагрівання заліза:
Q1 = cm(t2 - J1).
Кількість теплоти, яка необхідна для плавлення заліза:
Q2 = Хт.
Тоді загальна кількість теплоти, яку необхідно надати:
Q = Q1 + Q2-
Отримаємо:
Q - cm(t2 - tr) + Xm - m(c(t2 - I1) + X).
Перевіримо одиниці шуканої величини:
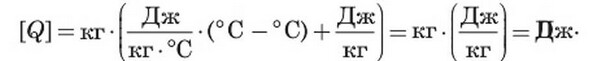
Знайдемо числове значення шуканої величини:

Запитання для самоперевірки
1. Що називають агрегатними перетвореннями речовини? Які агрегатні перетворення ви знаєте? Наведіть приклади.
Q. Який процес називають плавленням; кристалізацією?
3. Опишіть процес плавлення кристалічної речовини і поясніть його на основі молекулярно-кінетичної теорії будови речовини.
4. Чим відрізняється плавлення кристалічного тіла від плавлення аморфного тіла?
5. Чи можна розплавити свинець в олов’яній мисці?
6. Що називають питомою теплотою плавлення?
7. Питома теплота плавлення заліза 2,7-105 Дж/кг. Що це означає?
Завдання 10
1. Чому для вимірювання температури в північних районах використовують не ртутні, а спиртові термометри?
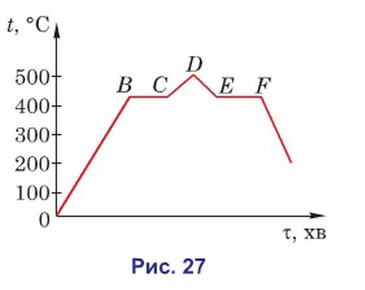
Q. На рисунку 27 наведено графік залежності температури цинку від часу його нагрівання.
Яким процесам відповідають ділянки графіка АВ, BC, CD, DE, EFl
3. Подайте графічно значення температури плавлення свинцю, алюмінію і срібла у вигляді стовпчастої діаграми.
4. Порівняйте внутрішню енергію 1 кг кристалічного і рідкого срібла при температурі плавлення.
5*. В залізній коробці з масою 400 г знаходиться олово з масою 200 г при температурі 32 °С. Яка кількість теплоти потрібна, щоб розплавити олово?
6*. Чавунна й алюмінієва деталі однакової маси перебувають при температурі 20°С. Для плавлення якої з цих деталей потрібна більша кількість теплоти? У скільки разів більша?
7в. Виконайте дослід. Заморозьте в холодильнику воду. Одержаний шматок льоду роздробіть і покладіть у стакан. Спостерігайте за зміною стану льоду і вимірюйте температуру. Відзначайте значення температури через рівні проміжки часу. Запишіть дані в таблицю. Побудуйте графік залежності температури льоду в склянці від часу його нагрівання. Якщо у вас є ваги, то попередньо зважте шматок льоду і розрахуйте кількість теплоти, яку отримає лід під час плавлення.
Вивчіть матеріал уроку і виконайте запропоновані в електронному додатку завдання.
Це матеріал з Підручника Фізика 8 Клас Пістун
Автор: evg от 10-08-2016, 12:41, Переглядів: 5155