§ 28. Природа електричного струму в розчинах і розплавах електролітів
Наллємо в одну посудину дистильовану воду, а в другу насиплемо кухонну сіль. Вставимо в посудину із сіллю два вугільні електроди так, щоб вони не доторкалися один до одного, але були зануреними в сіль. Приєднаємо до одного з них позитивний полюс джерела струму, а до другого — послідовно вимикач лампочки і негативний полюс джерела струму. Замкнемо коло вимикачем. Струму в колі не виникає, лампочка не світиться. Виймемо електроди зі склянки з сіллю, обтрусимо від залишків солі і помістимо у посудину з водою. І в цьому випадку струму в колі немає. Суха сіль і дистильована вода є діелектриками.
Залишивши електроди у посудині з водою, висиплемо у воду сіль. Помічаємо, що в міру розчинення солі лампочка світить дедалі яскравіше. У колі з’являється струм (мал. 2.103). Отже, розчин солі у воді стає провідником. А от якщо замість солі у воду добавити цукор, то такий розчин струм не проводитиме.
Речовини, розчини яких є провідниками електричного струму, називають електролітами.
До електролітів належать солі, оксиди, гідроксиди, кислоти, луги, розчини й розплави яких проводять струм.
На відміну від металів, провідність яких зумовлена електронами, струм в електролітах — це впорядкований рух іонів. Дистильована вода і суха сіль не мають іонів, які могли б переміщуватися під дією сил електричного поля. Іони провідності з’являються за рахунок розчинення солі у воді. Це саме стосується й набуття провідних властивостей розчинами й розплавами інших електролітів: лугів, кислот, оксидів та ін.
Молекули електроліту, які до розчинення були електрично нейтральними, при взаємодії з молекулами розчинника розпадаються на позитивні й негативні іони. Ці іони переміщуються під дією сил електричного поля, незалежно один від одного. Розпад молекул розчиненої речовини на іони під впливом молекул розчинника називають електролітичною дисоціацією. Так, при розчиненні кухонної солі NaCl молекули води оточу-
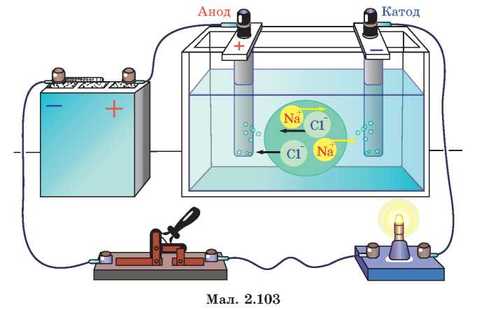
ють іони Na+ і Cl- і послаблюють зв’язок між ними. Молекула NaCl розпадається на два окремі іони, оточені нейтральними молекулами води. Іони, молекули води й молекули електроліту, які не розпалися на іони, перебувають у постійному хаотичному тепловому русі. Якщо в розчині електроліту створити електричне поле, то на тепловий хаотичний рух іонів накладається їх упорядкований рух — дрейф. Позитивні іони рухатимуться в бік електрода, з’єднаного з негативним полюсом джерела струму, а негативні — до електрода, приєднаного до позитивного полюса джерела струму. Так виникає струм в розчинах електролітів.
Електрод, з’єднаний з позитивним полюсом джерела струму, називають анодом. Електрод, з’єднаний з негативним полюсом джерела струму, називають катодом. Позитивні іони, що рухаються до катода, називають катіонами, негативні іони, які рухаються до анода, — аніонами. Електричний струм у розчинах електролітів — це упорядкований рух катіонів і аніонів.
У процесі руху позитивні і негативні іони іноді наближаються один до одного й об’єднуються в нейтральні молекули. Процес утворення нейтральної молекули з позитивного і негативного іонів називають рекомбінацією. У розчині електроліту з часом досягається рівновага. Кількість молекул, які розпадаються за одиницю часу на іони, стає рівною кількості молекул, які утворилися з іонів. З підвищенням температури розчину електроліту процес дисоціації стає більш інтенсивним, зростає концентрація іонів. Тому опір розчинів електролітів зі збільшенням температури зменшується.
ЗАПИТАННЯ ТА ЗАВДАННЯ 18 19 20 21 22 23
Це матеріал з Підручника Фізика 8 Клас Бойко
Автор: evg от 7-08-2016, 20:57, Переглядів: 2370