§ 2. Агрегатнi стани речовини
Агрегатні стани речовини
Ви дізнаєтесь
Які особливості руху молекул у рідкому, твердому та газоподібному станах
Пояснення агрегатних станів речовини на основі молекулярно-кінетичного вчення про будову речовини. Одна й та сама речовина може перебувати у твердому, рідкому та газоподібному станах, які називають агрегатними станами речовини.
Пригадайте
Що вам відомо про будову речовин
У природі різні стани тієї самої речовини найчастіше можна спостерігати на прикладі води (лід, вода, водяна пара). Склад цієї речовини в різних агрегатних станах незмінний — два атоми Гідрогену й один атом Оксигену (мал. 6).
На відміну від води, інші речовини в природі в усіх трьох агрегатних станах спостерігати складніше. Для цього потрібно створити відповідні умови (температура, тиск та інші). Назви таких речовин указують на їх агрегатний стан, наприклад, рідкий азот, пари ртуті, рідке олово.
З’ясуємо, у чому відмінність руху та взаємодії молекул речовини в різних агрегатних станах.

Газоподібний стан (або газ)1 — це стан речовини, в якому окремі молекули слабо взаємодіють між собою й рухаються хаотично. Середня кінетична енергія молекул є більшою, ніж їхня потенціальна енергія.
У газоподібному стані молекули майже не зазнають взаємного притягання. Зіштовхуючись між собою кілька мільярдів разів за секунду, вони змінюють напрям руху.
Відстань між атомами й молекулами газів набагато більша за їхні розміри (приблизно в десятки, а то й сотні разів). Цим, зокрема, пояснюється значна стисливість газів.
Слабкі сили притягання молекул газу не можуть утримати їх одну біля одної. Саме тому гази здатні безмежно розширюватись і не зберігають ані

форми, ані об’єму, тобто займають весь об’єм посудини, в якій вони містяться (мал. 7).
Ці ознаки зумовлені тим, що молекули газу між короткочасними зіткненнями перебувають у вільному русі.
Більшість речовин переходять у газоподібний стан з рідкого або твердого внаслідок нагрівання. Перехід із рідкого в газоподібний стан називають випаровуванням, а протилежний йому перехід із газоподібного стану в рідкий — конденсацією. Перехід із твердого стану в газоподібний, минаючи рідкий, називають сублімацією.
Прикладом сублімації є висихання білизни на морозі. Тобто у водяну пару перетворюється лід, а не вода.
Деякі речовини не мають газоподібного стану. Це речовини зі складною хімічною будовою, які при підвищенні температури розпадаються внаслідок хімічних реакцій раніше, ніж перетворюються на газ.
Здебільшого, у звичних для людини земних умовах, газ має однакову густину, температуру, тиск у будь-якій точці посудини, яку займає. Однак це не є універсальним законом. Наприклад, повітря в полі тяжіння нашої планети має різну густину, тиск і температуру: ці величини зменшуються з віддаленням від поверхні Землі.
У рідині молекули розташовані на відстанях, сумірних із їхніми розмірами. На таких відстанях сила, з якою притягуються молекули, має велике значення. Тому потенціальна енергія притягання молекул рідини більша, ніж кінетична енергія їхнього теплового руху. Однак молекули рідини достатньо рухливі, тому вони часто змінюють своє положення, рухаючись «стрибками». Молекули рідини перебувають здебільшого в щільному оточенні

сусідніх молекул. Коли ж раптово поруч виникає розрідження, то молекула проникає в нього. Таким чином вона потрапляє в «компанію» інших молекул і перебуває там доти, доки не з’явиться можливість для нового «стрибка». Рухаючись, молекули рідини в будь-який момент часу мають більш-менш упорядковане розташування, яке називають ближнім порядком. Однак цей порядок на великих відстанях не зберігається і саме тому й називається ближнім порядком.
У рідкому стані речовина зберігає об’єм, але не тримає форму. Це означає, що рідина може займати тільки частину об’єму посудини, але вільно перетікати й проникати в усі її закутки (мал. 8).
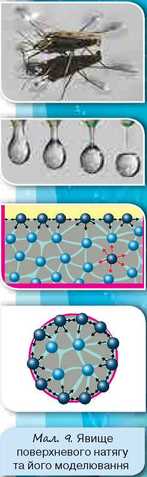
Рідина, на відміну від газу, має добре визначену поверхню. Такі явища, як змочування тіл, утворення крапель зумовлені саме особливостями взаємодії молекул, що містяться в поверхневому шарі рідини (мал. 9).
Вам, мабуть, доводилось бачити, як краплина води може розтікатися по поверхні, а може набувати форму кульки. Це зумовлено співвідношенням між силами притягання молекул рідини між собою та з молекулами твердого тіла, з яким контактує рідина.
Якщо молекули рідини притягуються одна до одної слабше, ніж до молекул твердого тіла, — то рідина розтікається (змочує поверхню) (мал. 10, а).
А якщо сили притягання між молекулами самої рідини сильніші, ніж сили притягання цих молекул до молекул твердого тіла, — то рідина набуває форму кулі (не змочує поверхню) (мал. 10, б).

Для більшості речовин рідина — проміжний стан між газом і твердим тілом. Речовина може переходити в рідкий стан із твердого в результаті процесу, який називається плавленням. Зворотний процес переходу з рідкого стану у твердий називається твердненням (або кристалізацією). У газоподібний стан рідина переходить унаслідок процесу пароутворення (кипіння й випаровування).
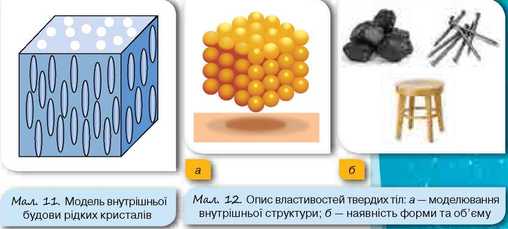
Оскільки можна вважати, що в рідин, як і в газів, рухливість молекул досить значна, то їхні фізичні властивості не залежать від порядку розташування молекул. Проте існують ще й рідкі кристали, які досить широко використовуються в сучасних годинниках, моніторах і телевізорах. Зазвичай довгі, вузькі молекули рідкого кристалу розміщуються так, як зображено на малюнку 11. (Детальніше властивості рідких кристалів ви будете вивчати в наступних параграфах).
У твердих тілах структурні частинки (атоми або молекули) перебувають дуже близько одна від одної. Саме тому сили притягання між молекулами є досить великими. Оскільки середня потенціальна енергія взаємного притягання молекул значно більша за їхню кінетичну енергію, то молекули можуть лише хаотично коливатись відносно своїх положень. Вільно переміщуватись (так само, як у рідинах або газах) молекули твердих тіл не можуть. Саме цим пояснюється те, що тверді тіла мають певну форму та об’єм (мал. 12).
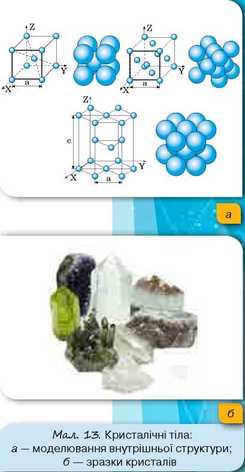
Тверді тіла можуть бути кристалічними або аморфними. Прикладами кристалічних тіл є кварц, золото, лід, гірський кришталь, кремній, галіт (кам’яна сіль) та багато інших. Для кристалічних твердих тіл характерне впорядковане розташування молекул (мал. 13).
Просторові фігури, у вершинах яких містяться структурні частки речовини, називаються комірками кристалічної ґратки. Такі комірки в кристалі повторюються в усіх трьох напрямах. Саме тому кристалам притаманний дальній порядок.
Тверді тіла, яким, так само як рідинам, дальній порядок не притаманний, називаються аморфними (наприклад, смола, парафін) (мал. 14).
Певна впорядкованість у розташуванні молекул твердих тіл зумовлює їхні фізичні властивості (теплопровідність, електропровідність, пружність та інші).
Вивчаючи теплові явища, ми найчастіше будемо досліджувати такі речовини:
■ гази — повітря, водяна пара, кисень, вуглекислий газ;
■ рідини — вода, нафта, ртуть, гас;
■ тверді тіла — лід, алюміній, залізо, чавун, смола, парафін, пластмаси. Тому не зайвим буде пригадати все,
що ви вивчали про ці речовини на уроках хімії, географії та біології.
Зміни агрегатного стану речовини. Будь-яке тверде тіло завдяки нагріванню може перейти в рідкий або газо-

подібний стан, тобто розплавитись або безпосередньо випаруватись. І навпаки, кожна рідина може стати твердим тілом, якщо її достатньою мірою охолодити (мал. 15). Кожній речовині потрібно створити відповідні умови (температура, тиск та ін.) для зміни агрегатного стану.
Наприклад, ртуть необхідно охолодити до -39 °С, щоб вона затвердла, тоді як залізо плавиться за 1539 °С. Ще вищою є температура плавлення таких сполук, як карбіди та оксиди. За температури вище 6000 °С жодна з відомих нам речовин не може існувати як тверде тіло.
Випаровуються не тільки рідини, а й тверді тіла. Так, шматок вольфраму за кімнатної температури навіть через тисячу років практично не втратить своєї маси. Якщо ж його помістити у вакуум за температури близько 3000 °С, то вже через день маса вольфраму зменшиться (приблизно на 1,7 грама з квадратного сантиметра поверхні).
Але ви повинні запам’ятати, що при зміні агрегатного стану склад молекул речовини не змінюється.
Плазма. Природно, виникає запитання: чи переходить газ у якийсь новий стан за значного збільшення температури? Такий стан існує, а речовина, яка перебуває в ньому, отримала назву плазма.
Плазмою називають різновид газу, який складається із «зруйнованих атомів»: йонів та окремих електронів. Плазма може утворитися за значного нагрівання газу.


При цьому молекули настільки інтенсивно рухаються, що під час зіткнення, унаслідок великої сили удару, вони можуть втратити свої зовнішні електрони і з’являються вільні електрони та йони.
Прикладом плазми (мал. 16) є речовина, з якої складаються Сонце та зорі. У земних умовах плазму можна спостерігати в атмосферних явищах: блискавка, північне сяйво. Полум’я також є плазмою.
Підбиваємо підсумки
Речовини можуть перебувати в різних агрегатних станах.
Склад молекули однієї й тієї самої речовини у твердому, рідкому та газоподібному станах однаковий.
Той чи інший агрегатний стан речовини визначається відмінністю між характером руху і взаємодії молекул.
Я знаю, вмію та можи пояснити
'
1. Назвіть агрегатні стани . Які особливості руху молекул у рідкому, твердому та газоподібному станах?
2. Що можна сказати про міжмолекулярні сили в різних агрегатних станах?
3. Яке співвідношення між кінетичною та потенціальною енергіями молекул для газоподібного, рідкого і твердого станів речовини?
4. Яка середня відстань між молекулами в газах, рідинах і твердих тілах?
ПОЯСНІТЬ
1. Чому тверді тіла й рідини не розпадаються на окремі молекули?
2. Що є причиною зміни агрегатного стану речовини?
Ви дізнаєтесь
Як і для чого вимірюють температуру
Автор: evg от 7-08-2016, 16:26, Переглядів: 14669