Взаємодія води з оксидами. Індикатори
Протилежності, поставлені поряд, стають більш явними.
Бонавентура
Опрацювавши матеріал параграфа, ви зможете:
• наводити формули кислот і основ;
• складати рівняння реакцій води з кальцій оксидом, натрій оксидом, фосфор(У) оксидом, карбон(ІУ) оксидом;
• розпізнавати дослідним шляхом кислоти і луги;
• оцінювати наслідки кислотних дощів.
Взаємодія води з оксидами доводить, що вона є хімічно активною речовиною. Гасіння вапна - реакція кальцій оксиду з водою - відбувається дуже бурхливо, супроводжується виділенням теплової енергії. Ось як описує цей процес Іван Франко у творі «Борислав сміється»: «В вапнярках шипіло та булькотіло вапно, немов лютилось, що його наперед спряжено в огні, а тепер назад вкинено у воду». Реакція відбувається за схемою:
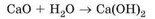
Перетворіть схему реакції на хімічне рівняння. До якого типу належить ця реакція?
Продукт реакції - кальцій гідроксид, основа. Його використовують для виготовлення будівельних розчинів. За положенням Кальцію в періодичній системі хімічних елементів визначимо його валентність. Кальцій -елемент головної п ідгрупи ІІ групи, він двовалентний. Гідроксильна група -ОН одновалентна, число гідроксильних груп у формулі основи дорівнює валентності металічного елемента в ній. Тому формула кальцій гідроксиду - Са(ОН)2. Подібно до кальцій оксиду з водою реагує натрій оксид:
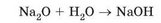
Перетворіть схему реакції на хімічне рівняння. До якого типу належить ця реакція?
Кальцій гідроксид і натрій гідроксид - розчинні основи, луги. Тому оксиди, гідратами яких вони є, називають основними. Гідрат - продукт реакції сполучення речовини з водою. Основні оксиди і гідроксиди - це оксиди й гідроксиди лише металічних елементів.
Кислоти - продукти взаємодії з водою кислотних оксидів. Фосфор(У) оксид - білий пухкий порошок, який активно реагує з водою. Реакція супроводжується виділенням великої кількості теплової енергії. Продукт реакції - ортофосфатна кислота:
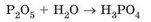
Ортофосфатну кислоту використовують для підкислювання деяких га-зованих напоїв. У їхньому складі є ще одна кислота - карбонатна - продукт реакції з водою карбон(ІУ) оксиду:
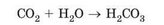
Зверніть увагу: кислотні оксиди і кислоти переважно утворені неме-талічними елементами. Однак трапляються металічні елементи, оксиди яких - кислотні. Наприклад, хром(УІ) оксид утворює хроматну Н2Сг04 і дихроматну Н2Сг207 кислоти.
Перетворіть схему реакції на хімічне рівняння. До якого типу належить ця реакція?
Приклади складання рівнянь реакцій з водою кислотних і основних оксидів наведено на схемі (рис. 28.1).

Рис. 28.1. Складання рівнянь реакцій кислотних (1) і основних (2) оксидів з водою. Ме - скорочене позначення металічного елемента
Кислотні опади. Унаслідок згоряння палива в повітря потрапляють кислотні оксиди - сульфур(ІУ) оксид, вуглекислий газ, нітроген(ІУ) оксид. Вони реагують з атмосферною вологою. Це призводить до утворення кислотних опадів (рис. 28.2).
Ось як описує наслідки цього екологічного лиха Оксана Забужко в поезії «Лист із дачі»: «У нас ізнову по кислотних дощах заіржавів город: почорнілі цурпалки гудиння над землею стирчать, як на згарищі спалений дріт».
Кислотні опади змінюють хімічний склад ґрунтів і поверхневих вод. Це негативно впливає на довкілля: гинуть мешканці водойм, рослини, погіршується здоров’я людей, руйнуються металеві конструкції, будівлі, пам’ятки
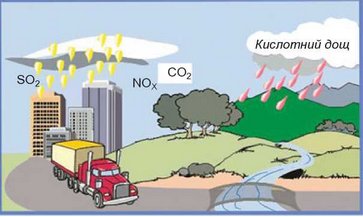
Рис. 28.2. Кислотні опади утворюються внаслідок взаємодії кислотних оксидів з водою
культури (рис. 28.3). Щоб запобігти утворенню кислотних опадів, потрібно обмежити надходження кислотних оксидів у повітря. Поширення інформації про причини й наслідки кислотних дощів сприятиме ефективнішому використанню енергії та зменшенню забруднення довкілля.

Рис. 28.3.Руйнівна дія кислотних опадів
Індикатори. Як можна пересвідчитися, що внаслідок реакцій кислотних оксидів з водою утворюються кислоти, а продуктами реакції з водою оксидів найбільш активних металічних елементів (Ьі, Па, К, М£, Са, Бг, Ва тощо) є основи? Для цього використовують кислотно-основні індикатори -речовини-визначники (пригадайте, про них уже йшлося в параграфі 2).
ЦікаВо і пізнаВально
Невтомний дослідник, Бойль не обмежився отриманням настоїв з квітів.
... Він зібрав цілющі трави, лишайники, чорнильний горішок, деревну кору і коріння рослин ... Багато різних за кольором настоїв приготував учений. Одні змінювали свій колір лише під дією кислот, інші - під дією лугів. Проте найцікавішим виявився фіолетовий настій, отриманий з лишайнику. Кислоти змінювали його колір на червоний, а луги - на синій. (За К. Маноловим).
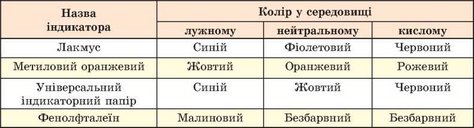
У шкільній хімічній лабораторії найчастіше використовують лакмус (або його синтетичний замінник лакмоїд), метиловий оранжевий і фенолфталеїн. Проте чи не найзручнішим є використання універсального індикаторного паперу, смужки якого просочені сумішшю індикаторів. Кольори індикаторів у різних середовищах наведено в таблиці 11.1.
Таблиця 11.1
Кольори індикаторів у різних середовищах
За допомогою метилового оранжевого, наприклад, можна визначити, у якій колбі - дистильована вода, а в якій - дощова вода, зібрана поблизу теплової електричної станції (рис. 28.4).

Щоб на власні очі побачити, як змінюються кольори індикаторів під впливом кислот і лугів, виконайте лабораторний дослід.
ЛАБОРАТОРНИЙ ДОСЛІД 5 Випробування водних розчинів кислот і лугів індикаторами
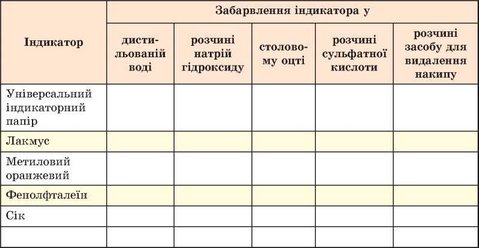
Вам видано штатив з пробірками (або пластину для крапельного аналізу), скляні палички, промивалку з дистильованою водою, оцет, розчини сульфатної кислоти, натрій гідроксиду, засобу для видалення накипу, універсальний індикаторний папір, розчини лакмусу, метилового оранжевого, фенолфталеїну, сік однієї з рослин (столового буряка, червоного винограду, червонокачанної капусти тощо).
Завдання. Виконайте досліди (за вказівкою вчителя - індивідуально або у складі малої навчальної групи): дослідіть, опишіть і порівняйте забарвлення індикаторів у дистильованій воді та в розчинах кислот і лугів. Для цього за допомогою скляної палички нанесіть по краплині досліджуваних розчинів на смужки індикаторного паперу. У пробірки (або заглибини пластини для крапельного аналізу) внесіть по 5 крапель досліджуваних розчинів. У кожну добавте по 1 краплі розчину індикатора.
Результати спостережень запишіть до таблиці такого зразка:
Більше про індикатори, основні та кислотні оксиди, луги й кислоти ви дізнаєтеся наступного навчального року.
ПРО ГОЛОВНЕ
Вода - хімічно активна речовина.
Продукти взаємодії кислотних оксидів - кислоти

Луги - розчинні основи.
Реакції з водою кислотних і основних оксидів є реакціями сполучення. Кислоти і луги в розчинах визначають за допомогою індикаторів. Забруднення повітря кислотними оксидами є причиною утворення кислотних опадів.
Перевірте себе
1. Які речовини утворюються внаслідок реакції з водою кислотних оксидів?
2. Як називають гідрати основних оксидів?
3. Які основи називають лугами?
4. Як експериментально визначають кислоти і луги у водних розчинах?
5. Що є причиною утворення кислотних опадів?
6. Яке джерело забруднення повітря кислотними оксидами?
7. Якими індикаторами можна виявити кислоту в розчині?
Застосуйте свої знання й уміння
8. Чому фенолфталеїн не можна використати для того, щоб розрізнити дистильовану воду і розчин лимонної кислоти?
9. Для чого досвідчені господині завжди додають до страв зі столового буряка (борщів, салатів) лимонний сік або оцет?
10. Чому в розчині засобу для видалення накипу універсальний індикаторний папірець набуває червоного забарвлення?
11. Класифікуйте оксиди, хімічні формули яких ВаО, Б03, И205, МдО, К20, на кислотні та основні.
12. Оксид хімічного елемента реагує з водою. У водному розчині продукту реакції фенолфталеїн набуває малинового забарвлення. Класифікуйте оксид і продукт його взаємодії з водою.
13. Оксид хімічного елемента реагує з водою. У водному розчині продукту реакції лакмус набуває червоного забарвлення. Класифікуйте оксид і продукт його взаємодії з водою.
14. Складіть узагальнювальну схему «Класифікація оксидів».
15. У засобі для чищення сантехнічних виробів «Йорж» є кислота, а в засобі для чищення газових плит цього самого виробника - луг. Поясніть, як експериментально можна розрізнити розчини цих засобів.
16. Марійка змішала буряковий сік з молоком. Суміш набула синього кольору. Спостерігаючи за цією сумішшю протягом кількох днів, Марійка помітила, що суміш поступово змінила колір на фіолетовий, а згодом - на рожевий. Поясніть імовірні причини явищ, за якими спостерігала Марійка.
17. Антін занурив смужку індикаторного паперу в зразок свіжого молока (рис. 28.5,1). Він залишив молоко в теплому місці й через кілька днів повторив спробу (рис. 28.5,2). Опишіть явища, які спостерігав Антін, і поясніть їх причини.

18. Для ліквідації шаруватих хмар застосовують вуглекислий газ у твердому стані -сухий лід. Його розпорошують з висоти кількох тисяч метрів. Потрапляючи до хмар, частинки реагенту концентрують вологу навколо себе, «витягаючи» з хмар воду. Тому майже відразу починається рясний дощ. Складіть рівняння реакції, яка відбувається під час перебігу описаного процесу. Спрогнозуйте забарвлення універсального індикаторного папірця у цій дощовій воді.
Творча майстерня
19. Недобросовісні виробники солодких газованих напоїв замінюють натуральну сировину (плоди, ягоди, коріння, трави) синтетичною. Уміст синтетичних барвників можна визначити, добавивши будь-якого лужного розчину: амоніаку, соди. Зміна характеру середовища спричиняє зміну кольору натуральних барвників. Натомість колір синтетичних барвників за цих умов не зміниться.
Оцініть вірогідність цієї інформації. Продумайте, як перевірити її експериментально. Обговоріть план свого дослідження з учителем хімії, порадьтеся з батьками. Виконайте досліди та підготуйте презентацію за результатами дослідження.
20. Дослідіть місцевість, у якій ви живете, спробуйте знайти докази того, що кислотні опади шкодять довкіллю. Сфотографуйте свої знахідки. Зробіть припущення, що саме могло спричинити утворення кислотних опадів. Укладіть список заходів, які сприятимуть зменшенню кислотних опадів. За результатами дослідження підготуйте презентацію.
Дізнайтеся більше про кислотні та основні оксиди, кислотні дощі (с. 182).
Це матеріал з підручника Хімія 7 клас Лашевська
Автор: admin от 12-02-2017, 11:48, Переглядів: 7509