Урок 9. Атоми та молекули
Мета: сформувати поняття про частинки, з яких побудовані речовини: атоми та молекули; поглибити та узагальнити знання про атом та його будову; ознайомити учнів з молекулярною та немолекулярною будовою речовин, установити залежність між властивостями речовин та їхньою будовою.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, кулестрижневі моделі атомів та молекул.
Базові поняття та терміни: атоми, молекули, йони, ядро, електрони.
Тип уроку: комбінований.
Методи навчання: пояснювально-ілюстративний: лекція; словесний: бесіда, репродуктивний, частково-пошуковий, проблемний.
Структура уроку
I. Організаційний момент 1 хв
II. Актуалізація опорних знань 9 хв
III. Вивчення нового матеріалу 20 хв
1. Атоми.
2. Молекули.
3. йони (матеріал розглядається на розсуд учителя).
4. Будова речовин.
IV. Узагальнення та систематизація знань 12 хв
V. Домашнє завдання 1 хв
VI. Підбиття підсумків уроку 2 хв
ХІД УРОКУ -
I. організаційний момент
II. актуалізація опорних знань
; Фронтальне опитування
— Дайте визначення поняттям: чиста речовина, однорідна та неоднорідна суміш.
— У чому полягає відмінність чистої речовини від суміші?
— Які способи розділення сумішей ви знаєте, чим вони відрізняються?
; Експрес-контроль знань
Під час бесіди деякі учні отримують картки із завданнями для експрес-контролю знань.
Варіант 1
1. У наведеному переліку підкресліть назви чистих речовин. Сірка, земля, мінеральна вода, цукор, мідь, пил, алюміній, повітря, кров, залізо.
2. Доповніть речення.
Морська вода — _ (чиста речовина чи суміш), тому що_.
З.Установіть послідовність операцій з розділення суміші піску, соди та заліза: 1. _, 2. _,
3._, 4._.
А фільтрування В дія магніту
Б випарювання Г розчинення
Варіант 2
1. У наведеному переліку підкресліть назви сумішей.
Олово, варення, залізо, нафта, пил, сірка, морська вода, повітря, кисень, алюміній.
2. Доповніть речення.
Очищене від пилу повітря —_(чиста речовина чи суміш), тому що_.
3. Установіть послідовність операцій з розділення суміші піску, тирси та солі: 1. _, 2. _,
3._, 4._.
А випарювання В фільтрування
Б відстоювання Г розчинення
; Бесіда
— Кожна речовина має індивідуальні властивості. Від чого вони залежать?
— Пригадайте, з яких частинок складаються речовини.
— Що означає слово «атом»?
— Чи можна побачити атом?
— Чи відомо вам, що таке молекула?
; Мотивація до навчання
Видатний американський фізик Річард Фейнман писав: «Якби у результаті якоїсь світової катастрофи усі накопичені людством знання були загублені й до майбутніх поколінь перейшла тільки одна фраза, то яке б твердження містило найбільше інформації? Я вважаю, що це — атомна гіпотеза: усі тіла складаються з атомів — маленьких тілець, які перебувають у безперервному русі, притягуються на невеликій відстані, але відштовхуються, якщо одне з них сильніше притиснуте до іншого».
— Чи згодні ви з ученим?
; Цілепокладання
Учитель повідомляє тему уроку та його план і запитує учнів, які питання щодо будови речовин їх цікавлять.
III. ВИВЧЕННЯ нового МАТЕРІАЛУ
— 1. Атоми ; Розповідь учителя
Ще давньогрецькі філософи стверджували, що всі речовини складаються з найдрібніших частинок речовини. Для них це було суто філософське питання. Існування таких частинок вперше було доведене античним філософом Демокрітом шляхом уявного експерименту. Якщо узяти камінь і подрібнити його, то вийде купка маленьких камінчиків. Якщо подрібнити один із таких камінчиків до порошку, то під лупою цей порошок виглядає такою самої купкою камінчиків, тільки дрібних. Якщо експериментувати далі й подрібнити крихточку порошку, то під мікроскопом ми все одно побачимо камінчики. Доки можна дробити предмети? Якщо припустити, що камінь можна дробити нескінченно, то врешті-решт цей камінь перетвориться на ніщо, на порожнечу. Але порожнеча не має маси, і якщо спробувати з такої порожнечі знову «зібрати» камінь, то у нас вийде невагома порожнеча. Отже, мають існувати якісь най-дрібніші частинки, що мають хоч і мале, але певне значення маси, проте які роздрібнити вже неможливо. Демокріт назвав ці частинки «атомосами», що в перекладі означає «неподільні».
Фізики ж довели існування атомів лише в ХІХ ст. за допомогою складних експериментів. Сьогодні існують фотографії атомів, зроблені за допомогою потужних електронних мікроскопів.
Атоми — це найдрібніші хімічно неподільні частинки речовини.
Важлива особливість атомів — їх не можна зруйнувати в результаті хімічних процесів. Але ще близько ста років тому вчені встановили, що атом має складну будову. У центрі атома є ядро, навколо якого рухаються електрони. Через це деякі вчені порівнювали будову атома з будовою Сонячної системи, й одна з перших моделей атома називалась планетарною. Але це порівняння дуже умовне, оскільки атом має складнішу будову.
Розміри атомів надзвичайно маленькі — близько 10-10 м (0,0000000001 м), а ядро атома ще менше — діаметр ядра дорівнює близько 10-15 м (0,000000000000001 м), тобто в сто тисяч разів менший, ніж діаметр атома. Якщо атом збільшили до розмірів яблука, то яблуко в цьому разі збільшиться до розмірів земної кулі. Ядро атома складається з інших частинок, які називаються нуклонами (від латин. nucleos — ядро). Електрон набагато менший за атомне ядро — у тисячу разів.
Ядро й електрони мають електричний заряд. Ядро позитивно заряджене. Заряд електрона — негативний і приймається як такий, що дорівнює -1 (електрон позначається як е). Завдяки тому, що ядро й електрони заряджені по-різному, електрони притягуються до ядра. Позитивний заряд ядра повністю компенсується негативним зарядом усіх електронів, які рухаються навколо нього. Тому сумарний заряд атома завжди дорівнює нулю, тобто атоми — це електронейтральні частинки. Зважаючи на це, за кількістю електронів можна визначити заряд ядра атома і навпаки. Наприклад, якщо атом має один електрон (заряд -1), то заряд ядра становить +1, а якщо заряд ядра атома +5, біля нього міститься 5 електронів (їх сумарний заряд дорівнює -5).
Отже, атоми — це найдрібніші електронейтральні частинки речовини, які складаються із позитивно зарядженого ядра й негативно заряджених електронів, що рухаються навколо ядра.
— 2. Молекули
; Розповідь учителя з демонстрацією моделей молекул
Багато речовин складаються з молекул. Один із видатних учених Середньовіччя Роберт Бойль найдрібніші частинки речовини називав корпускулами (від латин. «маленьке тільце», «частинка»). Через півстоліття їх стали називати «мас-корпускулами». Латиною слово «маса» звучить як «молес», «молес-корпускули», тому із часом їх стали називати скорочено — «молекули».
Молекули утворюються атомами, що з’єднуються один з одним у певному порядку за допомогою особливих хімічних зв’язків. В одній молекулі може об’єднуватися різне число атомів, причому атоми можуть сполучатися в різному порядку. Так утворюються молекули різних речовин. Наприклад, молекула кисню складається з двох атомів, молекула води — з трьох, а молекула сахарози — із сорока п’яти. Якщо атоми уявити у вигляді маленьких кульок, то молекули матимуть вигляд набору різних кульок певної форми та розмірів.
(Учитель демонструє моделі молекул.)
Молекули мають свої властивості, і ці властивості визначають, якою буде речовина. Кожна молекула має певні розміри та форму.
Молекули різних речовин не подібні між собою, тому й утворені ними речовини відрізняються за властивостями.
Молекула — це найменша частинка речовини, що здатна існувати самостійно і є носієм властивостей речовини. Молекули є елек-тронейтральними частинками, оскільки складаються з ектроней-тральних атомів.
3. йони (матеріал розглядається на розсуд учителя)
; Розповідь учителя
У природі електронейтральні атоми трапляються досить рідко. Найчастіше в результаті певних процесів під час перетворень речовин атоми віддають або приймають електрони. Тому заряд ядра вже не компенсується зарядом електронів, і атом перетворюється на електрично заряджену частинку. Такі частинки називають йонами.
Йони — це одноатомні або багатоатомні частинки, які мають електричний заряд. Вони можуть утворюватися з атомів унаслідок втрати або приєднання електронів.
Якщо атом приймає електрони, то у нього з’являється надмірний негативний заряд і він перетворюється на негативно заряджений йон.
Оскільки заряд електрона дорівнює -1, у йона, що утворився в результаті приєднання атомом одного електрона, з’являється заряд -1:
0 + (-1) = -1.
Відповідно, якщо атом приєднає два електрони, то заряд утвореного йона дорівнює -2:
0 + (-2) = -2.
Якщо ж атом втрачає електрони, то він перетворюється на позитивно заряджений йон. Заряд йона, який утворюється внаслідок втрати атомом одного електрона, дорівнює +1:
0 - (-1) = +1.
Якщо ж атом втрачає два або три електрони, заряд його йона дорівнює відповідно +2 або +3:
0 - 2(-1) = +2 або 0 - 3(-1) = +3.
— 4. Будова речовин ; Розповідь учителя
Молекули, атоми — це частинки, з яких складаються речовини. Коли ми говоримо про найдрібніші частинки речовини, то майже завжди маємо на увазі молекули. Молекули бувають найрізноманітніші. Наприклад, молекула кисню складається з двох атомів, а молекула сірки трохи більша — вона складається з восьми атомів. Молекули білків, що містяться у складі всіх живих організмів, набагато більші, у них налічуються сотні тисяч, а іноді й мільйони атомів.
(Учитель демонструє моделі молекул або ілюстрації на плакатах.)
Про речовини, які складаються з молекул, говорять, що вони мають молекулярну будову, і їх називають речовинами молекулярної будови.
Є речовини, молекули яких складаються лише з одного атома. До них належить, наприклад, гелій — газ, яким наповнюють повітряні кулі, а також багато інших речовин. У деяких речовинах узагалі складно виділити окремі молекули. Наприклад, алмази складаються з атомів, які дуже міцно з’єднані один з одним. Можна сказати, що кожний алмаз — це одна величезна молекула (супермолекула), що складається із сотень тисяч мільярдів атомів. Таких речовин доволі багато, і для них термін «молекула» зазвичай узагалі не застосовують. Про такі речовини говорять, що вони складаються з атомів і мають атомну будову. Атомну будову мають метали, кварц, кремній, графіт і багато інших речовин.
Багато речовин складаються з окремих протилежно заряджених йонів, як, наприклад, кухонна сіль. Про такі речовини говорять, що вони мають йонну будову.
Речовини, які складаються з атомів або йонів, називають речовинами немолекулярної будови.
Структура речовин значно впливає на їхні фізичні властивості. Між окремими молекулами взаємодія набагато слабша, ніж між атомами або йонами. Тому речовини молекулярної будови дуже крихкі й мають низькі температури плавлення й кипіння. За звичайних умов такі речовини найчастіше перебувають у рідкому або газоподібному стані. До речовин із молекулярною будовою належать вода, кисень, азот, вуглекислий газ, сірка, поліетилен, спирт тощо.
Речовини немолекулярної будови за звичайних умов завжди перебувають у твердому агрегатному стані. Завдяки сильній взаємодії між атомами та йонами вони мають високі температури плавлення й кипіння. До таких речовин належать кварц, алмаз, кухонна сіль, сода тощо.
IV. УЗАГАЛЬНЕННЯ ТА СИСТЕМАТИЗАЦІЯ ЗНАНЬ
; Робота з таблицею
Розглянемо таблицю, у якій наведені властивості деяких речовин. Проаналізуйте дані, зазначені в ній, подумайте, яку будову можуть мати ці речовини, та заповніть останній стовпчик.
(Таблицю можна зобразити на дошці або проектувати за допомогою мультимедійного проектора.)
Учитель аналізує і корегує припущення учнів.
Фізичні властивості деяких речовин
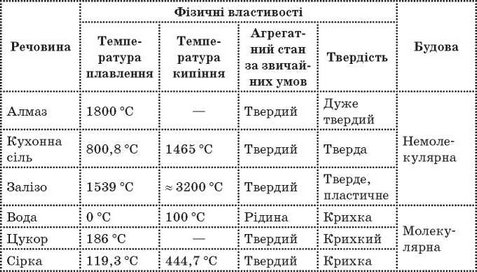
; Бесіда
Слід звернути увагу учнів на те, що молекули, атоми — це частинки, з яких складаються різні речовини, та організувати бесіду для з’ясування ступеня засвоєння теоретичної інформації.
— Чим відрізняються атоми від молекул?
— З яких частинок складаються атоми?
— Який заряд мають атомні ядра й електрони?
— Як з атомів утворюються йони?
— Чому в атомів з’являється заряд, якщо вони віддають або приймають електрони?
— Чим відрізняються за складом і властивостями речовини молекулярної і немолекулярної будови?
— У який найпростіший спосіб можна експериментально розпізнати, з яких частинок складається речовина?
— Як найпростіше експериментально розпізнати однакові за розміром кристали алмазу і льоду? Яка з цих речовин має молекулярну будову?
0 Виконання завдань
Для формування навичок з визначення заряду ядра атома чи кількості електронів слід виконати декілька практичних завдань.
1. Скільки електронів міститься у складі атома, якщо заряд його ядра дорівнює +8?
2. Визначте, який заряд матиме частинка, утворена:
а) ядром із зарядом +6 і шістьма електронами;
б) ядром із зарядом +9 і десятьма електронами;
в) ядром із зарядом +12 і десятьма електронами.
0 Робота в групах
Щоб зосередити увагу учнів на важливості теми уроку для розвитку науки та створити «місточок» до наступного уроку, можна об’єднати учнів у групи та запропонувати їм розв’язати «проблемне запитання»:
— Як можна пояснити існування в природі величезної різноманітності речовин?
Висловлювання дітей уточнюються вчителем і запам’ятовуються для використання на наступному уроці. Якщо на уроці бракує часу, це завдання можна залишити як додаткове для обговорення вдома.
V. домашнє завдання
1. Прочитати параграф підручника.
2. Відповісти на запитання та виконати завдання після параграфа. 3 . Поміркувати, як можна пояснити існування в природі величезної різноманітності речовин.
VI. підбиття підсумків уроку
Учитель запитує учнів, про що нове вони дізналися на уроці, чого навчилися. Чи знайшлись відповіді на запитання, що їх цікавили?
Учитель нагадує висловлювання американського фізика Фейнмана і просить учнів висловити своє ставлення до його слів.
Автор: admin от 20-01-2017, 23:56, Переглядів: 3749