Горение и окисление веществ в воздухе
Горение веществ в воздухе
Люди издавна задумывались над природой горения веществ. За тысячелетия развития науки выдвигалось множество гипотез, которые пытались объяснить, почему одни вещества горят, а другие — нет. Большинство из этих гипотез сегодня вызывают улыбку, а их изучение интересно разве что с исторической точки зрения.
Впервые современную теорию горения выдвинул французский химик А. Лавуазье. Он установил, что горение происходит при участии воздуха, а точнее, одного из его компонентов — кислорода. Кроме того, Лавуазье доказал, что воздух является не простым веществом, а смесью газов, и определил его состав.
Из всех газов, которые входят в состав воздуха, только кислород поддерживает горение. Горение веществ может происходить с различной скоростью в зависимости от активности вещества и содержания кислорода в воздухе. Активные вещества, такие как фосфор, метан, магний и другие, сгорают очень быстро (рис. 103). Менее активные вещества, например сахар, сгорают медленнее.
Существенным образом на активность горения влияет содержание кислорода в воздухе. Если бы в воздухе содержалось менее 15 % кислорода, то горение было бы невозможным. А если бы содержание кислорода превышало 30 %, то было бы очень сложно загасить огонь. Все деревья на нашей планете сгорели бы в результате лесных пожаров, которые мог бы потушить только очень сильный ливень.
Но главное, что при горении выделяется много теплоты (энергии), которую можно использовать для бытовых и промышленных нужд. Также при горении выделяется свет, и часто этот процесс сопровождается образованием пламени.
Выдающийся французский химик. С ранних лет проявлял интерес к физике и химии. Длительное время изучал горение веществ, первым установил, что в процессах горения и дыхания участвует кислород. Чтобы доказать состав алмаза, в складчину с друзьями купил большой бриллиант и сжег его, чем доказал, что алмазы состоят из атомов Карбона (рис. 102). Открыл закон сохранения массы веществ в химических реакциях. Доказал, что кислород и металлы являются простыми веществами, а вода — сложным. В то время химики считали воду простым веществом, поскольку не могли ее разложить. Ввел систему присвоения названий веществам, основанную на их составе. Дал современные названия многим элементам.


Взаимодействие веществ с кислородом может происходить медленно, без заметного выделения теплоты. В этом случае горение не наблюдается. Такие процессы называют медленным окислением. Например, железо при хранении на воздухе медленно превращается в рыжий порошок ржавчины, что условно можно описать уравнением:
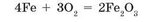
Медленное окисление — это процесс медленного взаимодействия веществ с кислородом без образования пламени и большого количества теплоты.
Медленное окисление отличается от горения отсутствием пламени и длительностью протекания. В повседневной жизни часто встречаются оба процесса. Мы разжигаем костер в лесу, сжигаем природный газ или дрова в печи и наблюдаем горение. Процессы медленного окисления не так заметны, но встречаются не менее редко. Все мы сталкивались с тем, что металлические предметы со временем тускнеют — покрываются слоем оксида. Если залезть в свежий стог сена, то можно ощутить тепло и запах веществ, выделяющихся при прении влажной травы. Из-за этой теплоты сено может даже воспламениться. Прение и гниение — примеры медленного окисления веществ в природе.
Процессы горения и медленного окисления могут переходить друг в друга: дрова в прогоревшем костре еще некоторое время продолжают тлеть, и наоборот, тлеющая спичка, брошенная в лесу, может стать причиной большого пожара. На предприятиях пропитанную смазочным маслом ветошь после обтирания станков запрещено накапливать в кучах. Внутри такой кучи процессы медленного окисления с выделением теплоты настолько повышают температуру, что может произойти самовозгорание. Медленное окисление способно при определенных условиях перейти в горение.
Взрыв
При некоторых условиях горение может происходить так быстро, что вещество взрывается. Обычно это происходит, если горючее вещество сильно измельчено. Например, муку горючим веществом назвать сложно, но на мукомольных заводах происходили взрывы, когда очень мелко смолотая мука, взвешенная в воздухе, взрывалась от небольшой искры.
Взрываться могут смеси кислорода с некоторыми газами. Смесь кислорода с водородом в соотношении 1 : 2 называют «гремучий газ». Он взрывается от наименьшей искры с образованием воды (рис. 104):
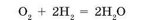
Взрываться могут смеси природного газа или угольной пыли с воздухом. Вот почему необходимо следить за исправностью газовых плит и газовых трубопроводов, расположенных в закрытых помещениях. Шахты постоянно проветриваются мощными насосами не только для того, чтобы в них легче дышалось, но и для того, чтобы уменьшить до безопасных значений содержание рудничного газа (метан), выделяющегося из угольных пластов.
На вентилях и трубопроводах, по которым подается чистый кислород, не должно быть даже следов смазочного масла. Масло, измельченное в капли, в потоке кислорода становится взрывчаткой огромной разрушительной силы.
Обычные опилки, пропитанные жидким кислородом, становятся взрывчатым веществом. Смеси пористых горючих материалов с жидким кислородом — оксиликвиты — применяют как взрывчатку при прокладывании туннелей, строительстве дамб, при добыче руды или камня в карьерах.
Условия возникновения и протекания реакции горения
Рассмотрим, от чего зависит протекание реакции горения. В первую очередь для начала горения необходим контакт горючего вещества с кислородом.
Если в закрытом пространстве горит какое-то вещество, то кислород быстро расходуется и горение прекращается.
Поэтому для поддержания беспрерывного горения в печах и каминах строят вытяжные трубы (рис. 105). Нагретые продукты сгорания легче воздуха и под-


нимаются вверх, а на их место поступает свежий воздух, обеспечивая доступ кислорода. Чем выше труба, тем сильнее тяга воздуха и тем активнее происходит горение.
Интенсивность горения зависит от содержания кислорода в воздухе. Поэтому, для того чтобы увеличить температуру пламени, сквозь него продувают воздух или подают чистый кислород (рис. 106). Этим приемом пользуются кузнецы, газосварщики, металлурги, стекловары. Возможно, вы также им пользовались. Вспомните, чтобы разжечь костер на пикнике, вы нагнетали воздух на загоревшиеся дрова.
Еще одним условием горения является то, что вещество должно быть нагретым до температуры воспламенения. Даже если вещество может гореть, но пока его не нагреть, оно не загорится. Например, бумага вспыхивает на воздухе в случае нагревания до 230 °С, а бензин нужно нагреть до 300 °С. Обычно для достижения температуры воспламенения вещество поджигают. Загоревшееся вещество продолжает гореть самостоятельно, так как в процессе горения выделяется большое количество теплоты, благодаря которой постепенно нагревается следующая порция вещества.
Температура воспламенения некоторых веществ близка к комнатной. Такие вещества вспыхивают на воздухе самостоятельно, без нагревания. Это явление называют самовоспламенением. К самовоспламеняющимся веществам относится белый фосфор, поэтому его нельзя хранить на воздухе, а только под слоем воды.
Итак, для возгорания горючих веществ необходимы два условия: доступ кислорода и нагревание вещества до температуры воспламенения. И наоборот, для того чтобы потушить горящий предмет, необходимо либо охладить его, либо перекрыть к нему доступ кислорода.

Тушение пламени
Часто для тушения огня используют воду. Она препятствует доступу воздуха и охлаждает предмет за счет испарения. Но есть вещества, которые нельзя тушить водой. К ним относятся некоторые металлы (калий, натрий), которые сами активно взаимодействуют с водой, что может только усилить пожар. Нельзя тушить водой и некоторые органические вещества, такие как бензин, керосин и др. Они легче воды, поэтому в случае попытки потушить их водой они всплывают на поверхность и продолжают гореть, распространяя пламя на соседние участки. Также нельзя тушить водой пожар, вызванный неисправным электрооборудованием.
Самый эффективный способ тушения пламени, используемый в химических лабораториях,— это прекращение доступа воздуха при помощи песка, пены, огнетушителей или специальных асбестовых одеял (рис. 107).
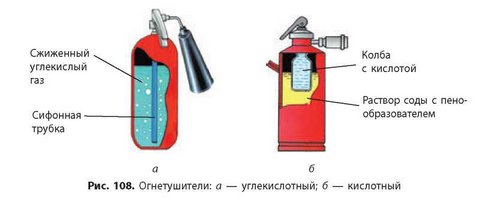
На прекращении доступа кислорода основано действие углекислотных огнетушителей (рис. 108а, с. 142). При открытии вентиля сжатый под давлением углекислый газ поступает в зону горения и перекрывает доступ кислорода к горючему веществу (сам углекислый газ не поддерживает горение). Конечно же, углекислый газ быстро испаряется, но за это время вещество успевает остыть и уже не загорается снова. В быту чаще используются кислотные или порошковые огнетушители. В кислотных огнетушителях (рис. 1086, с. 142) углекислый газ образуется в результате химической реакции соды с кислотой, а порошковые огнетушители разбрасывают

специальный порошок, который, попадая в пламя, разлагается с образованием углекислого газа.
В домашних условиях, чтобы потушить горящие предметы или одежду, загоревшуюся на человеке, необходимо набросить одеяло, шубу, ковер или покрывало и плотно завернуть, чтобы прекратить доступ воздуха.
Выводы:
1. Горение — быстрый процесс взаимодействия вещества с кислородом воздуха, сопровождающийся выделением теплоты и образованием пламени. Для возникновения горения необходимы доступ воздуха и нагревание вещества до температуры воспламенения.
2. Медленное окисление — это процесс медленного взаимодействия вещества с кислородом. Оно происходит с постепенным выделением теплоты и без пламени. При определенных условиях медленное окисление может переходить в горение и наоборот.
3. Взрыв — также реакция окисления. В отличие от горения, он происходит очень быстро, а выделяющаяся теплота (энергия) вызывает разрушения.
4. Для прекращения горения необходимо, чтобы не было хотя бы одного из условий его возникновения. Для этого необходимо либо охладить горящее вещество, либо перекрыть доступ воздуха.
Контрольные вопросы
1. Какие условия необходимы для возникновения горения?
2. Что общего между процессами горения, дыхания и гниения?
Задания для усвоения материала
1. Что общего и чем отличаются процессы горения, медленного окисления и взрыва?
2. Узнайте по справочнику, какие из атмосферных газов легче воздуха; тяжелее воздуха.
3. Объясните, что подразумевают под температурой воспламенения. Как вы считаете, от чего она зависит?
4. Прелые листья или сено на воздухе могут вспыхнуть. Объясните, почему это происходит.
5. Почему для тушения горящих предметов можно использовать плотное одеяло?
6. Вычислите, какая масса кислорода содержится в одной из комнат вашей квартиры.
7. Как вы считаете, почему на воздухе горение происходит медленнее, чем в чистом кислороде?
8. Почему тлеющие угли костра вспыхивают ярким пламенем, если на них сильно подуть?
9. Какой химический процесс является основой: а) разрушения древесины в случае длительного хранения; б) уменьшения прочности одежды из хлопка, льна и шелка со временем; в) саморазогревания влажного зерна в зернохранилище; г) разогревания почвы после внесения в нее навоза?
10. Можно ли использовать термин «молекула воздуха»? Ответ обоснуйте.
11*. Как вы считаете, каковы функции азота, кислорода, углекислого газа
и водяного пара в атмосфере Земли?
• Газ, который остается после прекращения горения, Лавуазье назвал «азот», что означает «безжизненный».
• Во времена Киевской Руси пожар, который начался от молнии, нельзя было тушить водой. Такой огонь считался божественным, и его тушили молоком.
Это материал учебника Химия 7 класс Григорович
Автор: admin от 19-01-2017, 03:27, Переглядів: 4065