Взаємодія води з оксидами
Поняття про кислоти й основи
Більшість оксидів здатні вступати в хімічні реакції з водою. Зазвичай ці реакції є реакціями сполучення, у результаті яких утворюються продукти приєднання води до оксидів. Речовини, що утворюються сполученням води з іншими речовинами, називають гідратами.
Залежно від того, з яким оксидом взаємодіє вода, може утворитися два типи гідратів: кислоти і основи. Кислоти складаються з атомів Гідрогену і кислотного залишку (H2SO4, Н2С03), а у формулах основ на першому місці записують металічний елемент, з яким сполучається гідроксильна група —ОН (KOH, Ba(OH)2). Залежно від гідрату, що відповідає певному оксиду, серед оксидів виділяють дві групи: кислотні оксиди та основні оксиди.
Кислотні оксиди
Усі кислотні оксиди, за винятком силіцій(ГУ) оксиду SiО2, за звичайних умов вступають у реакції сполучення з водою з утворенням кислот:
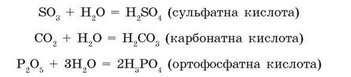
Оксиди, гідрати яких є кислотами, називають кислотними оксидами.
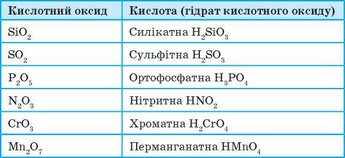
Більшість кислотних оксидів — це оксиди неметалічних елементів. Але кислотні оксиди можуть утворювати і металічні елементи, якщо ці елементи можуть виявляти високі валентності, вищі за чотири. Так, до кислотних оксидів належать хром(УІ) оксид Сг03 та манган(УІІ) оксид Мп207.
Формули найбільш поширених кислотних оксидів та відповідних їм кислот наведено в таблиці 5.
Таблиця 5. Кислотні оксиди та відповідні їм кислоти
Основні оксиди
Продукти реакції оксидів із водою (гідрати) можуть виявляти основні властивості. Якщо гідрат оксиду є основою, то такий оксид є основним.
Оксиди, гідрати яких є основами, називають основними оксидами.
До основних оксидів належать оксиди металічних елементів. Це здебільшого оксиди одно-, дво-, а іноді тривалентних металічних елементів (табл. 6).
Таблиця 6. Основні оксиди та відповідні їм основи
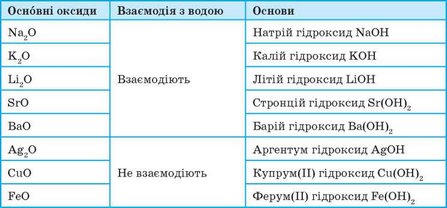
Більшість основних оксидів із водою не взаємодіють. У реакцію з водою вступають лише оксиди, гідрати яких розчиняються у воді (див. табл 6, с. 161). Такі гідрати називають лугами:
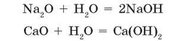
Єдиний кислотний оксид, що за звичайних умов не взаємодіє з водою, — це силіцій(^) оксид SiO2, якому відповідає силікатна кислота H2SiO3. Він дуже поширений у природі у складі мінералу кварцу. Звичайний кварцовий пісок на берегах морів і річок — це і є силіцій(^) оксид.
При взаємодії кальцій оксиду (негашеного вапна) з водою утворюється кальцій гідроксид (гашене вапно). Під час цієї реакції з водою виділяється настільки багато теплоти, що вода може закипіти. Цю реакцію використовують у так званих хімічних грілках для розігрівання сніданків або напоїв в одноразових пакетах.
Виявлення кислот і основ у розчинах
Більшість оксидів і відповідних їм гідратів — безбарвні сполуки, тому визначити їх наявність або розрізнити кислоти й основи без «сторонньої допомоги» неможливо. Для виявлення кислот і основ у розчинах використовують індикатори — складні органічні сполуки, що змінюють своє забарвлення залежно від наявності кислоти або основи в розчині (мал. 114). Найпоширеніші індикатори та їхній колір за наявності кислот та основ наведено в таблиці 7.
Таблиця 7. Забарвлення деяких індикаторів за наявності кислот і основ та у воді
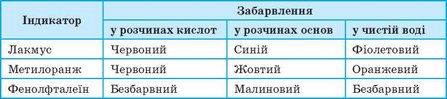
Здебільшого індикатори використовують у вигляді розчинів — у воді або в спирті. Зручніше використовувати індикаторний папір — звичайний папір, просочений розчином індикатору, а потім висушений. У продаж він потрапляє у вигляді набору тоненьких смужечок (мал. 115).

ЛАБОРАТОРНИЙ ДОСЛІД № 5
Випробування водних розчинів кислот і лугів індикаторами
Обладнання: штатив із пробірками.
Реактиви: розчини основи, кислоти, вода, метилоранж, фенолфталеїн, лакмус.
Правила безпеки:
• використовуйте невеликі кількості реактивів;
• остерігайтеся потрапляння реактивів на одяг, шкіру, в очі.
1. Підготуйте по три пробірки з водою, розчином кислоти та розчином основи.
2. У першу пробірку з водою додайте кілька крапель розчину метилоранжу, у другу — лакмусу, у третю — фенолфталеїну.
3. Так само додайте індикатори в пробірки з розчинами кислоти й основи.
4. Порівняйте забарвлення індикаторів у різних пробірках і запишіть результати в зошит.
5. Зробіть висновок щодо виявлення кислот і основ індикаторами.
Висновки:
1. Оксиди здатні сполучатися з водою з утворенням гідратів. Гідрати кислотних оксидів — кислоти, а основних — основи.
2. До кислотних оксидів належать оксиди неметалічних елементів та оксиди металічних елементів із валентністю, вищою за IV. До основних оксидів належать оксиди металічних елементів із валентністю І, ІІ та іноді ІІІ.
3. Для виявлення кислот та основ у розчині використовують індикатори — речовини, забарвлення яких змінюється за наявності кислоти чи основи.
Контрольні запитання
1. Які оксиди називають кислотними, а які — основними?
2. Які речовини називають гідратами?
3. Які кислотні оксиди за звичайних умов взаємодіють з водою, а які — ні? Які з основних оксидів здатні взаємодіяти з водою?
Завдання для засвоєння матеріалу
1. Як можна добути з кислотного оксиду кислоту? Наведіть рівняння реакцій кислотних і основних оксидів з водою.
2. Із наведеного переліку випишіть в окремі стовпчики формули оксидів: а) кислотних; б) основних. №20, Р205, С02, Б03, СгО, Си20, БІО2, Мп207.
3. Які з наведених оксидів взаємодіють із водою? Складіть відповідні рівняння реакцій. №20, С02, Б03, СгО, БІО2.
4. Розчин, що утворився при розчиненні газуватого оксиду у воді, забарвлює лакмус у червоний колір. Який це газ міг бути?
5. Гасіння вапна — це взаємодія негашеного вапна (кальцій оксиду) з водою. Складіть рівняння цієї реакції.
6. Як ви вважаєте, чи можна знайти в природних умовах фосфор(У) оксид, сульфур(УІ) оксид та натрій оксид? Відповідь поясніть.
7. Доповніть схеми реакцій і назвіть продукти реакції:
а) І_І20 + Н20 ^......; б) Б02 + Н20 ^......; в) ......+ Н20 ^ Ва(0Н)2.
8*. Деякі оксиди використовують як осушувачі для зневоднення газів та деяких неводних рідин. На якому принципі ґрунтується дія оксидів як осушувачів? Які оксиди можна так використовувати і чому саме їх?
Це матеріал з підручника Хімія 7 клас Григорович
Автор: admin от 18-01-2017, 22:47, Переглядів: 42251