Чисті речовини та суміші
Пригадайте: речовини складаються з найдрібніших частинок — атомів і молекул, кожній речовині відповідає певний набір атомів або молекул.
Суміші та чисті речовини в природі
У природі речовини в індивідуальному стані — чисті речовини — майже не трапляються (мал. 37, с. 44). Частіше речовини в природі змішані одна з одною й утворюють суміші. Сумішами є морська та газована вода, молоко та сік, граніт і сталь.

Зазвичай хімікам не потрібні абсолютно чисті речовини, але іноді сторонні домішки можуть заважати виконанню дослідів. Тому на банках із хімічними реактивами обов'язково вказується ступінь їхньої чистоти. Етикетка з написом «Техн.» (технічна) указує на високий, до кількох відсотків, уміст домішок. Для хімічних дослідів такі речовини не використовують, але в будівництві та на заводах такого ступеня чистоти достатньо. Ступінь чистоти «Ч» (чиста) або «ХЧ»
(хімічно чиста) означає, що домішок мало, менше за один відсоток. Чисті речовини вже можна використовувати для виробництва ліків, а хімічно
чисті — для наукових дослідів. У деяких випадках потрібні дуже чисті речовини. Такі реактиви позначаються «ОСЧ» (особливо чисті), у них міститься менше за 10-6 відсотка домішок. Такі речовини потрібні для дуже точних експериментів, а також у виробництві мікросхем для комп'ютерів.
Очищення речовин — це дорогий процес, тому чим чистішою є речовина, тим вона дорожча. Наприклад, особливо чисті мідь і залізо коштують значно дорожче за звичайне золото.
Поняттями «суміші» та «чисті речовини» користувалися ще давньогрецькі учені. Згідно з їхніми уявленнями, чиста речовина складається з частинок одного виду, а суміш — із частинок різних видів.
Коли хіміки говорять про якусь речовину, мається на увазі, що вона є чистою і складається з частинок одного виду. Однак на практиці ідеально чисту речовину отримати майже неможливо. Серед частинок однієї речовини обов’язково траплятимуться декілька

частинок іншої. Навіть ті речовини, які називають чистими, містять сторонні частинки інших речовин — домішки.
Однорідні та неоднорідні суміші
У багатьох випадках ми не можемо розрізнити окремі речовини у складі суміші. Так, ми не помічаємо, що повітря — це суміш декількох газуватих речовин. На вигляд не можна визначити, що молоко — це суміш різних речовин, що більшість металевих предметів зроблено зі сплавів, а не з чистих металів. Такі суміші називають однорідними. У них частинки, які утворюють суміш, такі малі, що їх неможливо роздивитися неозброєним оком (мал. 38).

Коли ми п’ємо чай, каву або інші напої, ми маємо справу з водними розчинами різних речовин. Окремі частинки цукру або інші сполуки в них побачити неможливо, тому всі розчини є однорідними сумішами.
Розглядаючи граніт (мал. 39а), можна помітити в ньому рожеві зерна та прозорі кристали. Це приклад неоднорідної суміші. У таких сумішах окремі речовини помітні неозброєним оком.
Властивості чистих речовин і сумішей
На малюнку 40 частинки двох чистих речовин схематично зображені у вигляді кульок різного кольору. Перемішаємо ці кульки. Чи змінилися вони після цього? Ні, вони просто перемішалися. Ані форма, ані розмір, ані колір кульок унаслідок змішування не змінилися. Так і в суміші всі речовини — компоненти — зберігають свої властивості. Отже, ґрунтуючись на цих властивостях, суміші можна розділити на окремі компоненти.

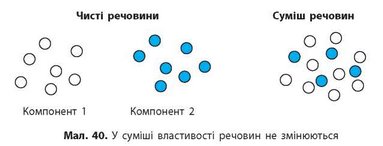
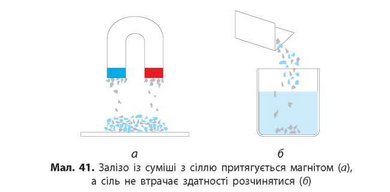
Наприклад, якщо піднести магніт до суміші залізного порошку та кухонної солі, то залізо до нього притягнеться, а сіль — ні (мал. 41). Якщо цю суміш помістити у воду, то сіль розчиниться, а залізо — ні.
Цукор має солодкий смак, а лимонна кислота — кислий. Спробуйте розчинити у воді невелику кількість цукру й лимонної кислоти. Який смак матиме ця суміш? Кислий плюс солодкий дорівнює кисло-солодкий. Отже, кожна речовина в суміші не змінює своїх властивостей і надає деяких своїх властивостей усій суміші.
На принципі зберігання властивостей речовин у суміші ґрунтується виготовлення матеріалів, адже більшість матеріалів є сумішами. Наприклад, чисте золото є дуже м'яким металом, предмети з якого можуть зіпсуватися навіть від слабкого удару. тому для виготовлення ювелірних виробів до золота обов'язково додають певну кількість міді або срібла. Звичайно ж, колір такої суміші (сплаву) трохи відрізняється від кольору чистого золота, проте вироби з неї стають значно міцнішими.
Як відрізнити чисту речовину від суміші?

Це легко зробити, якщо суміш неоднорідна і її окремі компоненти добре видно, як, наприклад, піщинки у воді. Чиста речовина завжди однорідна, тож навіть у разі значного збільшення її зображення під мікроскопом усі частинки, з яких вона складається, матимуть однаковий вигляд.
Іноді, щоб відрізнити суміш від чистої речовини, можна скористатися мікроскопом. Молоко
має вигляд однорідної рідини, але під мікроскопом у ньому видно дрібні крапельки жиру, що плавають у рідині (мал. 42). Але навіть під найсильнішим мікроскопом ми не зможемо побачити окремих частинок у водному розчині цукру. Розчин, звісно, набуде солодкого смаку, але в хімічній лабораторії куштувати речовини не можна!
У цьому випадку нам допоможуть знання про фізичні властивості речовин.
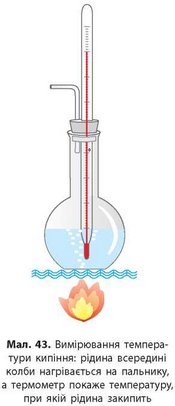
Хоча кожна речовина надає своїх властивостей суміші, але ніколи суміш не має таких самих властивостей, як кожна з чистих речовин окремо. Наприклад, температура, при якій плавиться сплав олова та свинцю, нижча за температуру плавлення чистого олова або чистого свинцю. Морська вода або розчин солі у воді замерзає при нижчій, а кипить при вищій температурі, ніж чиста вода.
У цьому випадку досить виміряти температуру плавлення або кипіння суміші (мал. 43) і порівняти результат із даними довідника для чистих речовин. Якщо є відхилення від довідкових даних, то досліджувана речовина не чиста, а є сумішшю.
Розділення сумішей
Суміш можна розділити на окремі компоненти, якщо знати їхні фізичні властивості. Суміш, компоненти якої суттєво відрізняються за властивостями, розділити легко. Але якщо властивості речовин подібні, цей процес ускладнюється. Сучасні хіміки навчилися розділяти майже будь-які суміші, навіть такі, що містять велику кількість компонентів.
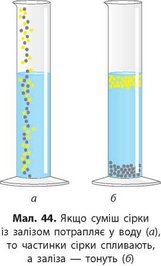
У воді, зачерпнутій з річки, є домішки мулу, піску та розчинених солей. Пісок від води можна легко відокремити відстоюванням — важкі піщинки швидко осідатимуть на дні. Цей метод називають відстоюванням. Він ґрунтується на тому, що легші речовини спливають на поверхню, а важчі — осідають на дно
посудини (мал. 44). Цим методом можна відокремити, наприклад, вершки від свіжого молока, оскільки крапельки жиру легші за воду і спливають на поверхню, утворюючи вершки.
Якщо частинки в рідині дуже подрібнені й майже не осідають, то їх можна відокремити фільтруванням. Наприклад, для очищення річкової води від річкового мулу її можна пропустити крізь фільтр. У хімічних лабораторіях використовують спеціальний фільтрувальний папір (мал. 45а). Це звичайний папір, у якому дуже маленькі пори (отвори). Для фільтрування суміш води з мулом наливають у лійку з паперовим фільтром (мал. 456). Молекули води дуже дрібні, набагато дрібніші за будь-які тверді частинки, які видно неозброєним оком. Вони легко проходять крізь пори у фільтрі, а великі частинки, розмір яких більший за розмір пор, затримуються фільтром (мал. 45в).
Фільтруванням можна розділити тільки неоднорідні суміші. В однорідних сумішах із водою (розчинах) розчинені частинки за розмірами подібні до молекул води і легко проходять крізь фільтр. Але такі суміші можна розділити випарюванням або перегонкою.

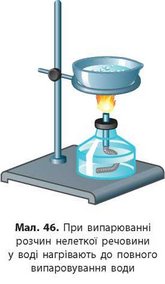
Якщо необхідно виділити розчинені речовини, розчин наливають у порцелянову чашку й випарюють (мал. 46). Вода випарується, а розчинені речовини залишаться на дні чашки. Випарюванням можна розділити суміш нелеткої речовини з леткою.
Для розділення сумішей двох летких речовин випарювання застосовувати не можна. Суміш таких речовин можна розділити перегонкою (мал. 47). Для цього суміш поміщають у колбу і нагрівають. Рідина, що кипить при нижчій температурі, випаровується першою, і її випари потрапляють у холодильник. У холодильнику вони конденсуються (перетворюються на рідину), і в приймач стікає краплями чиста рідина. Цей метод розділення сумішей називають ще дистиляцією, тому воду, очищену в такий спосіб, називають дистильованою.
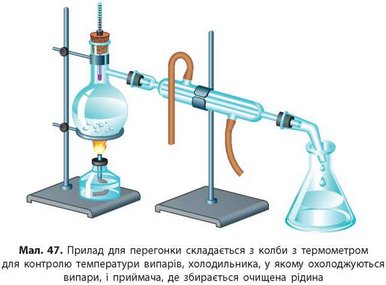
Перегонкою можна розділити однорідну суміш двох рідин, які киплять при різних температурах, наприклад, суміш спирту з водою. При нагріванні такої суміші спочатку випаровується і збирається в приймачі рідина з нижчою температурою кипіння — спирт. Коли весь спирт википить, рідина в колбі продовжить нагріватися, а при температурі 100 °С почне випаровуватися вода.
Дією магніту можна виділити з неоднорідної суміші речовину, яка має магнітні властивості (мал. 41, с. 46).
Використовуючи описані методи, можна розділити більшість сумішей на чисті речовини, з якими мають справу більшість хіміків.
! Лінгвістична задача
Грецькою мовою суміші називають словом «міксис». Яке значення, на вашу думку, мають слова «мікстура», «міксер»?
У перекладі з латинської distille означає «крапля». Як ви вважаєте, чому перегонка рідин отримала назву «дистиляція»?
Висновки:
1. Чисті речовини утворені з однакових частинок, а суміші — з різних складових частинок. Чисті речовини, що містяться у складі сумішей, називають компонентами суміші. У неоднорідних сумішах частинки компонентів видно неозброєним оком, а в однорідних сумішах окремих компонентів не видно, і на вигляд вони здаються чистими речовинами.
2. У сумішах речовини зберігають свої властивості і надають їх суміші. На цьому ґрунтується можливість розділення суміші речовин на чисті речовини. Для розділення сумішей найчастіше використовують фільтрування, відстоювання, випарювання, перегонку та дію магнітом.
Контрольні запитання
1. Дайте визначення суміші. Які суміші називаються однорідними, а які — неоднорідними? Наведіть приклади.
2. Чи існують у природі абсолютно чисті речовини?
3. Чи змінюються властивості речовин у суміші? Чому?
4. Як відрізнити чисту речовину від суміші речовин?
Завдання для засвоєння матеріалу
1. Чим відрізняються суміші від чистих речовин? Виберіть правильні відповіді: а) чисті речовини утворені однаковими молекулами, а суміші — різними; б) чисті речовини утворені різними молекулами, а суміші — однаковими; в) у суміші речовини змінюють свої властивості; г) унаслідок змішування властивості компонентів суміші не змінюються; д) у властивостях суміші виявляються властивості її окремих компонентів.
2. Випишіть окремо назви сумішей і чистих речовин: кисень, річкова вода, водопровідна вода, мінеральна вода, дистильована вода, кухонна сіль, повітря, цукор, бензин, кров, зубна паста, золото, попіл.
3. Однорідна чи неоднорідна суміш утворюється внаслідок змішування: а) одеколону та води; б) борошна та води; в) меду та чаю; г) піску та каміння; д)бензину та води?
4. Чому не вдається виділити жир зі свіжого молока фільтруванням?
5. Наведіть не менше п'яти прикладів однорідних і неоднорідних сумішей, які трапляються вам у повсякденному житті.
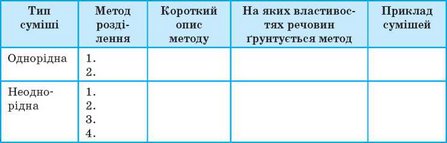
6. Які методи розділення сумішей вам відомі? На яких властивостях речовин вони ґрунтуються? Наведіть приклади сумішей, які можна розділити цими методами. Свою відповідь оформте у вигляді таблиці:
7. У який спосіб можна розділити суміші: а) води та бензину; б) цукру та піску; в) піску та тирси; г) борошна та ошурок; д) крохмалю та цукру?
8. Наведіть приклад використання методу відстоювання у побуті.
91. Що являє собою питна вода? Дізнайтесь, як вода потрапляє до вашої домівки. Чи можна вважати водопровідну воду чистою? Чи може в природі існувати чиста вода? Поговоріть з дорослими та дізнайтесь, яких заходів можна вжити, щоб поліпшити якість питної води.
ПРАКТИЧНА РОБОТА № 2
Розділення неоднорідної суміші
Обладнання: нагрівальний прилад, сірники, лабораторний штатив із кільцем і муфтою, скляна паличка, хімічні склянки, мірний циліндр, лійка, порцелянова чашка, шпатель або ложечка, фільтрувальний папір.
Реактиви: кухонна сіль, пісок, вода.
І Правила безпеки:
• пригадайте правила роботи з нагрівальними приладами;
• пригадайте правила безпеки при нагріванні.
1. У хімічну склянку шпателем помістіть невелику кількість суміші кухонної солі з піском і додайте мірним циліндром 10-20 мл води. Скляною паличкою ретельно перемішайте суміш до повного розчинення солі.
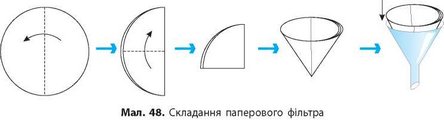
2. Складіть фільтр із фільтрувального паперу, як показано на малюнку 48, і відфільтруйте пісок.
3. Складіть прилад для випарювання (див. мал. 25 б, с. 30). Використовуючи скляну паличку, перелийте фільтрат (рідину, що пройшла крізь фільтр) у порцелянову чашку. Запаліть спиртівку і випарюйте воду. На дні чашки залишиться чиста сіль.
4. За результатами практичної роботи зробіть висновки.
При формулюванні висновків дайте відповіді на запитання:
1. Які методи розділення сумішей ви використали в цій роботі?
2. Які властивості солі й піску дозволяють використовувати саме ці методи для розділення суміші?
Це матеріал з підручника Хімія 7 клас Григорович
Автор: admin от 18-01-2017, 22:32, Переглядів: 20986