Генетика бактерій, вірусів і одноклітинних еукаріотів
Прокаріотична клітина відрізняється порівняно простою організацією (відсутність ядра та розвиненої компартменталізації, відсутність мейозу, порівняно невелика кількість ДНК), що робить її зручним об'єктом досліджень. Саме вивчення прокаріотів зіграло провідну роль у з'ясування багатьох базових принципів функціонування генетичного апарату, особливо в перші десятиліття після початку інтенсивних досліджень молекулярних основ спадковості. При збереженні загальних принципів, організація та функціонування спадкового апарату таких порівняно простих систем має певні особливості.
ОРГАНІЗАЦІЯ ГЕНЕТИЧНОГО АПАРАТУ ПРОКАРІОТІВ
Як правило, бактеріальний геном представлений однією циркулярною молекулою ДНК (бактеріальною хромосомою). Ця ДНК взаємодіє з білками, формуючи нуклеоїд, який займає певну зону бактеріальної клітини. Загальна довжина хромосоми, наприклад, у Escherichia coli, становить 4,6 млн пар основ, близько 90 % яких припадають на кодуючі послідовності (див. табл. 1.1). Середній розмір гена E. coli - 950 пар основ (прокаріотичні гени не містять інтронів), середня довжина міжген-ної ділянки - 118 пар основ. Проте міжгенні зони мають досить нерівномірний розподіл по довжині, яка варіює від 0 до 1730 пар основ.
У бактеріальному геномі присутні також мобільні елементи класу ДНК-транспозонів, цілком аналогічні транспозонам у геномах еукарі-отів (див. розділ 6). Бактеріальні транспозони поділяють на два типи, які дещо різняться між собою за будовою послідовностей і довжиною: IS-елементи (insertion sequences), розмір яких варіює від 700 до 1400 пар основ, і власне транспозони (Tn) більшого розміру. Транспозони обох типів часто містять гени транспозази. Транспозаза здійснює каталіз хімічних реакцій, які забезпечують переміщення транс-позона в інше місце геному (див. розділ 6). Крім генів транспозази у складі Tn-транспозонів можуть бути присутніми інші гени.
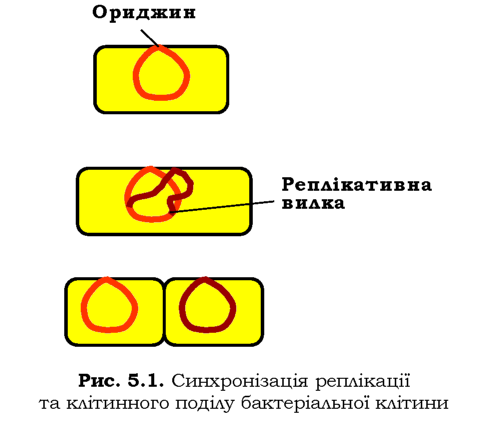
Реплікація бактеріальної хромосоми розпочинається з ділянки ориджину (як правило, єдиного, розділ 1) і продовжується в обидва боки двома реплікативними вилками (рис. 5.1). Вважається, що ори-джин при цьому взаємодіє з клітинною мембраною; між новим (щойно синтезованим) і старим ориджинами під час реплікації нарощується клітинна оболонка, по завершенні реплікації відбувається поділ дочірніх клітин - до кожної переходить повний материнський набір генів.
Характерною відзнакою бактерій є наявність у клітині, поряд із бактеріальною хромосомою, невеликих автономних елементів геному -плазмід. Плазміда є циркулярною молекулою ДНК (типовий розмір близько 3 тис. пар основ), яка містить кілька генів і реплікується незалежно від бактеріальної хромосоми (має власний ориджин). Плазмі -ди широко використовуються як зручний інструмент молекулярно-біологічних досліджень (див. розділ 9).
ОБМІН ГЕНЕТИЧНИМ МАТЕРІАЛОМ МІЖ БАКТЕРІЯМИ
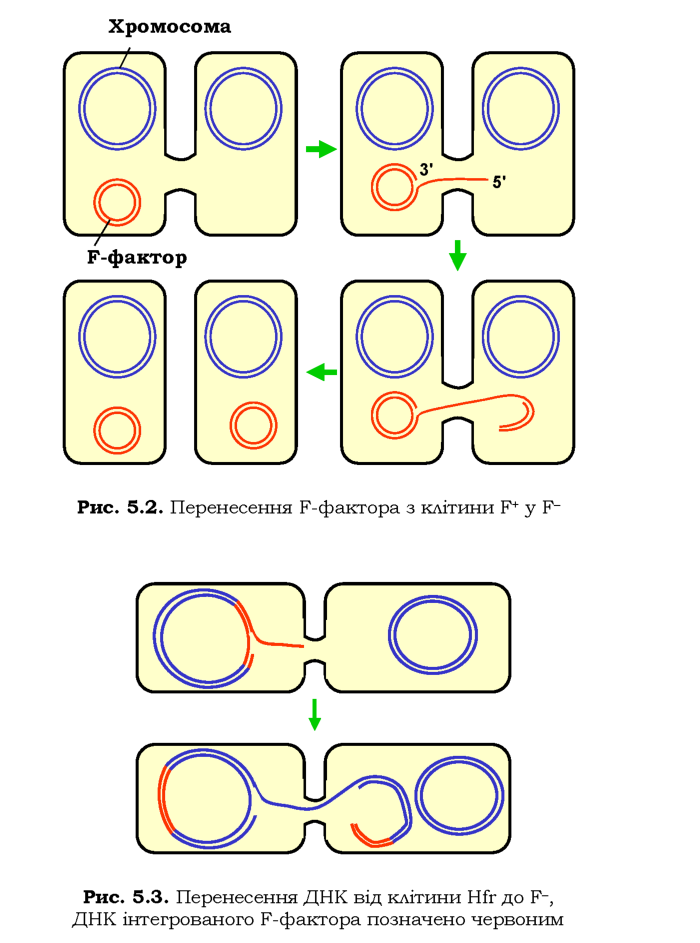
Хоча бактерії розмножуються шляхом клітинного поділу, у них спостерігається також своєрідний "статевий процес" перенесення генетичного матеріалу від однієї клітини до іншої. Таке перенесення відбувається під час кон'югації - безпосереднього контакту між клітинами. Залежить кон'югація від присутності в одній із клітин особливої плазміди - F-фактора (фактора фертильності) - яка, як і багато інших плазмід, може існувати автономно, а може вбудовуватись у бактеріальну хромосому шляхом сайт-специфічної рекомбінації. В E. coli існує два "статеві" типи клітин, що позначаються як F+ і F-, - кон'югація супроводжується перенесенням ДНК від клітини F+ до F-.
F-фактор містить кілька генів, у тому числі такі, що відповідають за утворення так званих пілів - трубчастих виростів на поверхні клітини. Пілі з'єднуються з рецепторами клітин F-, і між клітинами двох типів утворюється цитоплазматичний місток (рис. 5.2). Специфічна нуклеаза робить одноланцюговий розріз у ДНК F-фактора, інтактний ланцюг слугує матрицею для добудови З'-кінця, що залишився в місці розрізу, - відбувається реплікація циркулярної ДНК F-фактора за так званим типом кільця, що котиться (такий механізм реплікації використовується також для копіювання ДНК багатьох бактеріофагів). Процес добудови З'-кінця виштовхує 5'-кінцеву одноланцюгову ділянку, яка проникає у клітину F-, де використовується як матриця для синтезу другого ланцюга ДНК. У результаті клітина F- перетворюється на F+ (рис. 5.З).
Частота кон'югації та подвоєння і перенесення F-фактора є невисокою (~10-5), якщо F-фактор існує автономно від бактеріальної хромосоми (як на рис. 5.2). Коли F-фактор вбудовується в бактеріальну хромосому, частота зростає до 10-2-10-1 - такі штами клітин F+ позначаються як Hfr (high frequency recombination). При кон'югації клітин F- і Hfr вбудований F-фактор ініціює реплікацію за типом кільця, що котиться, цілої бактеріальної хромосоми (рис. 5.З): у клітині Hfr хромосома відновлюється, у клітину F- переноситься її копія. Насправді ж ціла хромосома потрапляє до клітини F- дуже рідко - як правило, відбувається порушення кон'югаційної трубки й розрив хромосоми, котра переноситься, (як видно з рис. 5.З, це не порушує вихідну хромосому у клітині Hfr - там завжди є інтактний ланцюг ДНК, який може бути використаний у ролі матриці для відновлення цілісності дволан-цюгової молекули). Оскільки на початку процесу в клітину F- потрапляє лише частина F-фактора, а щоб він опинився там повністю, вихідна хромосома має зробити повний "оберт" (рис. 5.3), як правило, клітина F- не перетворюється на F+ при кон'югації з клітиною Hfr.
Коли в клітині F- опиняється частина гомологічної ДНК іншої бактерії, починається гомологічна рекомбінація, описана в розділі 1, - обмін ділянками між донорною ДНК і ДНК клітини-реципієнта. Результуюча клітина-реципієнт залишається гаплоїдною - "зайва" ДНК, що не потрапила до хазяйської хромосоми, піддається деградації нуклеа-зами, оскільки вона не є циркулярною. Таким чином, між двома бактеріальними штамами відбувається своєрідне часткове схрещування, яке можна досліджувати за допомогою звичайних методів генетичного аналізу. Розглянемо, наприклад, схрещування Hfr-штаму дикого типу за генами thr+ та leu+ (визначають здатність синтезувати відповідні амінокислоти), який містить також ген чутливості до стрептоміцину StrS, із штамом F-, що має ген стійкості до стрептоміцину StrR і мутантні гени thr та leu- (ауксотрофний штам, який потребує присутності відповідних амінокислот у поживному середовищі):
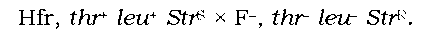
З певною частотою в такому схрещуванні утворюються рекомбіна-нтні бактерії дикого типу F-, thr+ leu+ StrR, які можна відібрати, вирощуючи культуру на середовищі зі стрептоміцином.
Оскільки перенесення генів із клітини Hfr у F- відбувається послідовно, починаючи із сайта інтеграції F-фактора (рис. 5.3), можна кар-тувати розміщення генів у бактеріальній хромосомі (у порядку потрапляння їх до клітини F-). Для цього кон'югацію (після змішування клітин двох типів у рідкому середовищі) зупиняють шляхом струшування пробірки через певні проміжки часу. Це дозволило свого часу отримати детальні генетичні карти бактеріальної хромосоми (відстані на таких картах вимірюють у хвилинах) і довести її циркулярність.
F-фактор, інтегрований до хромосоми, може також вирізатися з неї з утворенням автономної плазміди. Таке вирізання іноді буває неточним: ділянка F-фактора залишається в хромосомі, замінюючись на ділянку хромосоми в складі плазміди. Утворюється так званий F'-фактор, який здатен переносити в інші клітини бактеріальні гени незалежно від бактеріальної хромосоми (явище сексдукціі). Після такого перенесення можна отримати частково диплоїдні клітини - за генами, що перебувають у складі F'-фактора. Між останнім і хромосомою клітини-реципієнта можлива гомологічна рекомбінація, що приводить або до утворення Hfr-клітин і дуплікації генів (одиночний кросинговер - вбудовування F'-фактора у хромосому), або до обміну ділянками між хромосомою та F'-фактором (подвійний кросинговер).
Бактеріофаги (бактеріальні віруси) поділяють на два типи: вірулентні, які проникають у клітину, розмножуються та зумовлюють руйнування клітини (літичний шлях), і помірні - такі, що можуть використовувати або літичний шлях, або шлях лізогеніі, коли ДНК фага за допомогою сайт-специфічної рекомбінації (див. наступний підрозділ) вбудовується в бактеріальний геном (фаг перетворюється на профаг). В останньому випадку за несприятливих для бактерії умов може відбуватися індукція бактеріофага - перехід до літичного шляху.
Процес перенесення генетичного матеріалу між бактеріальними клітинами за рахунок активності бактеріофагів називають трансдукцією. Здійснюють її зазвичай помірні бактеріофаги: після практично необмеженого існування фагової ДНК у бактеріальному геномі, індукція іноді зумовлює вирізання фагової ДНК разом із бактеріальними ділянками. Далі відбувається реплікація цієї ДНК, синтез білків оболонки бактеріофага (закодованих у генах фагової ДНК) і збирання фаго-вих частинок. Фагові частинки потім інфікують інші клітини, і якщо реалізується шлях лізогенії, вбудовуються в ДНК клітини-хазяїна разом із захопленими раніше бактеріальними генами. До помірних фагів належать, зокрема, фаги Р1, Р22, X (див. нижче огляд життєвого циклу фага X). ДНК помірних фагів може розглядатися як частина бактеріального геному, яка іноді виходить з під контролю: гени бактеріофага жодним чином не відрізняються від бактеріальних, тобто перебувають під контролем промоторів, що впізнаються бактеріальною РНК-полімеразою клітини-хазяїна.
Бактеріофаги групи Т відносять до таких, що реалізують тільки літичний шлях. Як і для помірних фагів, їхній геном представлений однією лінійною дволанцюговою ДНК. ДНК Т-парних фагів (Т2, Т4, Т6) містить приблизно 200 тис. пар основ, фагові гени кодують білки системи реплікації (у тому числі й власну ДНК-полімеразу), білки фагової оболонки та певні регуляторні білки, що сприяють перемиканню роботи клітинних систем на користь бактеріофага. Після проникнення ДНК у клітину починається транскрипція групи фагових генів бактеріальною РНК-полімеразою, згодом - реплікація фагової ДНК, синтез фагових білків, збирання частинок бактеріофага й лізис клітини.
Аналогічно реалізується літичний шлях Т-непарними фагами (Т1, Т3, Т5, Т7), ДНК яких є трохи меншою за розміром (~40 тис. пар основ). Відразу після проникнення ДНК у клітину-хазяїна відбувається експресія гена мономерної фагової РНК-полімерази, яка далі ефективно транскрибує інші гени бактеріофага.
Бактеріальні клітини мають свою систему захисту від ДНК бактеріофагів. Основою цієї своєрідної "імунної системи" є рестриктази - велика група специфічних нуклеаз, які розрізають лише певні невеличкі (частіше чотири або шість нуклеотидів) елементи послідовності. Активність рестриктази залежить від метилювання певних азотистих основ у складі специфічних сайтів рестрикції: сайти у складі бактеріальної ДНК є метильованими й тому непомітними для рестриктази, немети-льовані сайти ДНК бактеріофага залишаються чутливими.
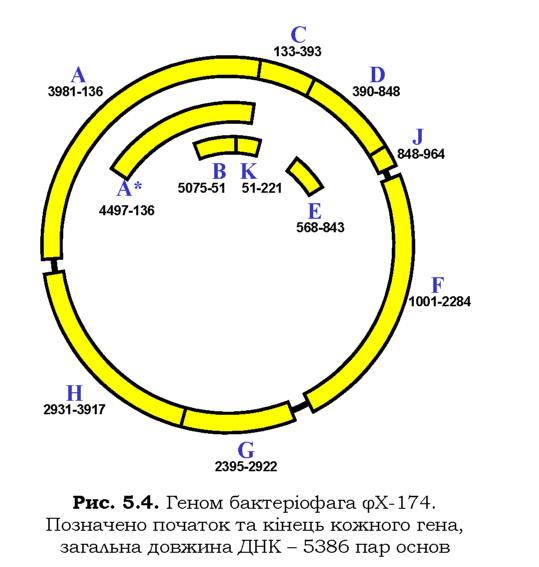
Крім фагів, котрі містять дволанцюгову ДНК як генетичний матеріал, існують ще дві групи фагів, геном яких є відхиленням від "канону". Перша група - бактеріофаги з одноланцюговою циркулярною ДНК (фХ-174, М13). Ця ДНК досить маленька, фагові гени кодують тільки 10-12 білків. Наприклад, геном (який був першим із прочитаних) фХ-174 (слід читати "фі-десять") побудований надзвичайно економно: десять генів (один із них - ген А - дає дві різні молекули РНК при транскрипції) займають практично всю циркулярну ДНК бактеріофага (рис. 5.4). Більш того, декілька генів перекриваються за рахунок використання різних рамок зчитування: гени А і С та С і D перекриваються своїми кінцями, гени B, K і E повністю містяться в межах інших генів; три гени - А, С і K - використовують усі три можливі рамки зчитування на одній ділянці ДНК (звичайно, у даному випадку всі три рамки є відкритими). Явище перекриття генів за рахунок використання різних рамок зчитування спостерігається також для кількох інших бактеріофагів і зустрічається в еукаріотів.
У бактеріальній клітині фагова ДНК, що позначається як (+)-ланцюг, використовується як матриця для синтезу (-)-ланцюга. У результаті утворюється дволанцюгова циркулярна ДНК, з неї транскрибуються гени ((-)-ланцюг є матричним), і вона, після одноланцюгового розриву в (+)-ланцюзі, використовується для реплікації за типом кільця, що котиться (див. рис. 5.2): на циркулярному (-)-ланцюзі синтезується велика кількість копій (+)-ланцюга, фрагменти нарізаються, замикаються в кільце й упаковуються у фагову оболонку.
Остання група бактеріофагів (R17, F2, MS2) містить як генетичний матеріал молекулу РНК, де є тільки чотири гени (фагова РНК одночасно слугує як мРНК), що кодують: РНК-залежну РНК-полімеразу, яка здійснює копіювання фагової РНК; два білки оболонки; білок, що забезпечує лізис клітини. Таким чином, ці найменші з усіх відомих вірусів здійснюють найпростіший шлях передачі спадкової інформації - тільки з РНК на РНК і на білок.
Як приклад сайт-специфічної рекомбінації розглянемо уже згадану інсерцію (інтеграцію) ДНК бактеріофага X в бактеріальну хромосому. У складі фагової ДНК є сайт attP - ділянка довжиною 270 пар основ, у складі бактеріальної ДНК - сайт attВ (23 пари основ). Обидва сайти мають ділянку спільної (або гомологічної) послідовності довжиною 15 пар основ. Два білки - бактеріальний IHF (Integration Host Factor) і продукт одного з генів бактеріофага інтеграза - зв'язуються з цими сайтами (рис. 5.5).
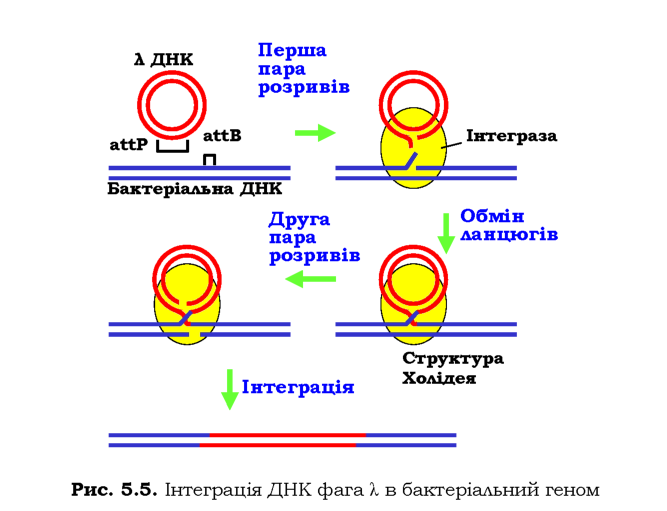
Інтеграза здійснює два одноланцюгові розрізи в бактеріальній і фа-говій ДНК, після чого відновлює фосфодіефірний зв'язок, але з відповідним кінцем іншого дуплекса - відбувається обмін ланцюгами. На цьому етапі утворюється конфігурація чотирьох ланцюгів, еквівалентна структурі Холідея (див. також рис. 1.25). Після цього здійснюється друга пара розривів і обмінів ланцюгами, що й зумовлює інтеграцію.
Розглянутий приклад указує на основну різницю між сайт-специфічною та гомологічною рекомбінаціями: якщо при гомологічній рекомбінації дві молекули ДНК упізнають одна одну шляхом порівняння своїх послідовностей уздовж великих ділянок (див. розділ 1), сайт-специфічна рекомбінація передбачає наявність також гомологічних, але коротких елементів послідовності, що впізнаються специфічними білками.
Процеси сайт-специфічної рекомбінації за механізмом, цілком аналогічним розглянутому, дуже поширені в бактеріофагів, при ін-серції плазмід в основний геном у бактерій і дріжджів, вирізанні пла-змід. Практично сайт-специфічною рекомбінацією є і переміщення ДНК-транспозона. Що стосується вищих еукаріотів, одним із головних процесів, у ході якого використовуються механізми сайт-специфічної рекомбінації, є дозрівання імуноглобулінових генів (розділ 6).
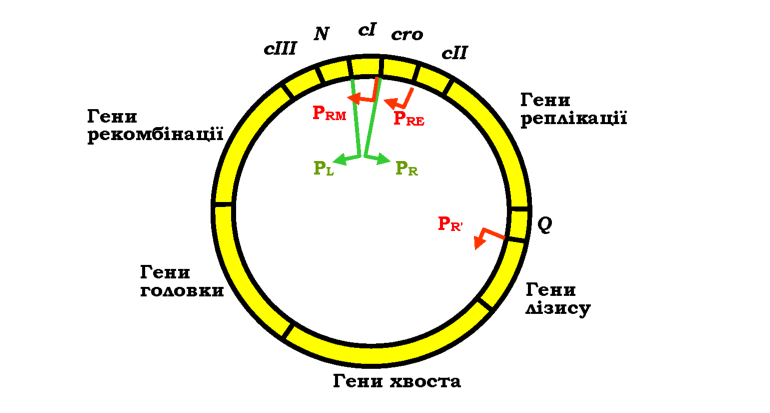
Життєвий цикл фага к є чудовим прикладом добре вивченої системи регуляції транскрипції в масштабі хоча й невеличкого, але цілого геному. Після проникнення в бактеріальну клітину лінійна ДНК бактеріофага X замикається в кільце бактеріальною лігазою. Геном фага містить гени, які відповідають за синтез білків головки та хвоста фа-гової частинки, реплікацію фагової ДНК, лізис бактерії, рекомбінацію (вбудовування фагової ДНК у бактеріальний геном), і кілька регуляторних генів, що кодують фактори транскрипції (рис. 5.6).
 |
|
Рис. 5.6. Циркулярна ДНК бактеріофага X. Стрілочками позначено промотори та напрямок транскрипції: зелені - сильні промотори, червоні - такі, що потребують активації. |
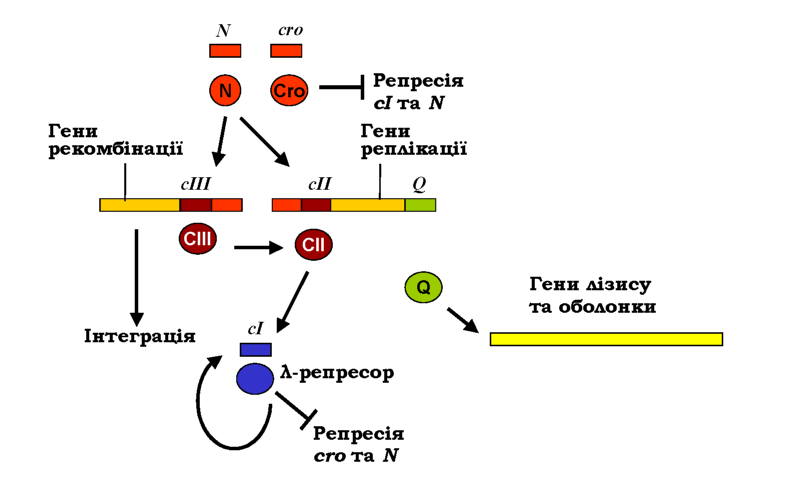
Відразу після інфекції РНК-полімераза зв'язується з двома сильними промоторами Pr і Pl (рис. 5.6), з яких відбувається транскрипція у протилежних напрямах на генах сго і N відповідно (рис. 5.7). Обидва гени закінчуються термінаторами, але щойно з'являється білок N, він виконує роль антитермінатора - забезпечує ігнорування РНК-полі-меразою сигналів термінації, і вона продовжує синтезувати поліцист-ронну мРНК на сІІІ та генах рекомбінації (із промотора Pl) і сІІ, генах реплікації та Q (з промотора Pr). Після цього можливе розгалуження на два альтернативні шляхи.
Розглянемо спочатку шлях лізогенії. Продукт гена сІІ - активатор транскрипції, який забезпечує зв'язування РНК-полімерази зі слабким промотором Pre. Із цього промотора (у напрямку, протилежному напрямку транскрипції ero, рис. 5.6) транскрибується ген сІ, продуктом якого є білок ^-репресор. Крім того, білок СІІ активує ген інтегрази (міститься серед генів рекомбінації) - ферменту, що забезпечує вбудовування фагової ДНК у геном клітини-хазяїна. Продукт гена сІІІ захищає білок СІІ від бактеріальних протеаз, тобто підвищує час життя активатора. Отже, за умови високої концентрації СІІ з'являється певна кількість ^-репресора, а фагова ДНК вбудовується інтегразою в бактеріальний геном (рис. 5.7).
 |
|
Рис. 5.7. Схема регуляції транскрипції в життєвому циклі фага А. Прямокутники - транскрипти, отримані з відповідних генів, овали - білки |
Репресор має спорідненість до операторних ділянок, розташованих між промоторами Pr і Prm, а також у зоні промотора Pl. Взаємодія з операторами веде до блокування промотора Pr гена сго та автоматично блокує всі гени праворуч від нього. Так само репресор блокує промотор Pl, тобто транскрипцію всіх генів ліворуч від N. Разом із тим репресор є активатором власного гена сІ із промотора Prm. Отже, на стадії лізогенії тільки ген сІ є активним (рис. 5.7). Накопи-чення репресора та насичення ним операторних ділянок зумовлює вимикання цього промотора - за принципом зворотного зв'язку реп-ресор підтримує активність свого гена на певному оптимальному рівні.
Якщо бактерія піддається дії мутагенів, коли виникає ризик загибелі клітини (разом із вбудованою фаговою ДНК), відбувається активація певної бактеріальної протеази, яка гідролізує молекулу репресо-ра, результатом чого є втрата його спорідненості до ДНК. Унаслідок звільнення промоторів PR і PL РНК-полімераза зв'язується з ними й починає транскрибувати гени cro та N, тобто знов виникає ситуація, що спостерігається відразу після інфекції - спрацьовують гени рекомбінації, сІІ, реплікації та ген Q. Але при цьому білок СІІ швидко деградується протеазами, не встигаючи активувати синтез репресора. Така сама ситуація (висока активність протеаз) може, звичайно, реалізуватися відразу після інфекції.
Білок Cro заповнює ті самі операторні ділянки між промоторами PR і PRM, але тепер ця взаємодія остаточно вимикає синтез репресора з промотора Prm. Подальше заповнення операторів при зростанні концентрації Cro вимикає транскрипцію cro і генів праворуч від нього, так само, як і генів ліворуч від N за рахунок зв'язування Cro з операторами в зоні промотора Pl. Але головний наслідок активності cro полягає у появі білка Q.
Ще один промотор Pr' є насправді сильним, але відразу за ним розташований термінатор - РНК-полімераза у відсутності Q синтезує з цього промотора короткий нефункціональний транскрипт. Білок Q спрацьовує як антитермінатор, забезпечуючи долання цього бар'єру. У результаті відбувається синтез поліцистронної мРНК на генах лізису та білків оболонки (праворуч від Q), паралельно активність генів рекомбінації забезпечує вирізання фагової ДНК, а генів реплікації - 'її ампліфікацію: здійснюється збирання фагових частинок і лізис клітини.
Розглянута досить складна система регуляції транскрипції порівняно простого геному бактеріофага X має дати уявлення про те, наскільки ускладнюється загальна система регуляції транскрипції у бактерій і тим більше - в еукаріотів. Насправді складність загальних систем внутрішньоклітинної регуляції, які залежать від тонкого балансу великої кількості різноманітних впливів, залишається дуже далекою від остаточного розуміння.
Віруси, що розмножуються в еукаріотичних клітинах, представлені всіма можливими варіантами щодо типу нуклеїнової кислоти, яка є носієм генетичної інформації. Залежно від цього та від шляху реалізації генетичної інформації віруси поділяють на сім класів. Шляхи експресії для шести з них показано на рис. 5.8, сьомий клас поєднує властивості класів І і VL При експресії вірусної спадкової програми врешті-решт синтезується молекула мРНК, що слугує матрицею для синтезу вірусних білків клітинною системою трансляції. Полінуклео-тидний ланцюг мРНК позначають як (+)-ланцюг, він комплементарний (-)-ланцюгу або ДНК, або РНК.
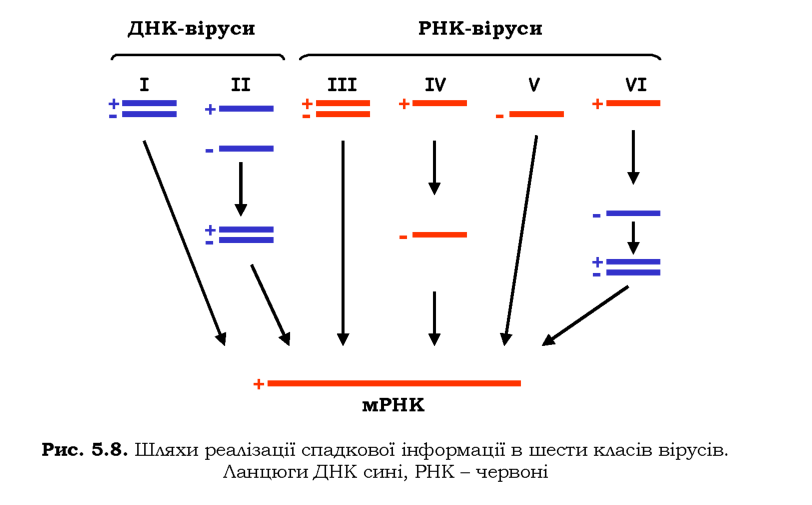
Віруси класу І містять дволанцюгову ДНК і, відповідно, використовують канонічний шлях реалізації спадкової інформації. Більшість із них (аденовіруси, бакуловіруси, віруси герпесу, папіломавіруси людини, вірус мавпи SV-40) застосовують транскрипційний апарат клі-тини-хазяїна для синтезу мРНК, реплікація вірусної ДНК здійснюється у клітинному ядрі. Розмір геному варіює від 5,5 до 150 тис. пар основ. Як і бактеріофаги, ці ДНК-віруси можуть реалізувати лізогенетичний шлях, зберігаючись у геномі клітини-хазяїна. Поксвіруси (варіола,
вакцинія), що також належать до класу І, мають ДНК досить великого розміру (~200 тис. пар основ) і власні ферменти, за допомогою яких здійснюється транскрипція та реплікація вірусної ДНК у цитоплазмі.
Віруси класу ІІ, зокрема парвовіруси, містять одноланцюгову ДНК (~5 тис. нуклеотидів) - у вірусних частинках різних вірусів є або тільки (-)-ланцюг, або один із двох типів ланцюгів. У будь-якому випадку на одноланцюговій ДНК у клітині відбувається синтез іншого ланцюга, після чого дволанцюгова ДНК служить субстратом для транскрипції та реплікації.
РНК-віруси класу ІІІ - реовіруси - використовують дволанцюгову РНК як сховище спадкової інформації. Вірусна частинка містить 10-12 окремих молекул довжиною 1-4 тис. пар основ, а також власні ферменти, що здійснюють у цитоплазмі реплікацію РНК і ампліфікацію (+)-ланцюга як мРНК для синтезу білків.
Віруси класу IV - поліовіруси, пікорнавіруси - мають одноланцюгову РНК (7-10 тис. нуклеотидів), яка є (+)-ланцюгом - РНК безпосередньо кодує вірусні білки й тому інфекційна сама по собі. Вірусна РНК є матрицею для синтезу (-)-ланцюгів, які далі використовуються для синтезу більшої кількості (+)-ланцюгів. На (+)-ланцюзі відбувається синтез єдиного поліпептиду - поліпротеїну, - який потім розрізається на окремі вірусні білки.
РНК вірусів класу V - ортоміксовіруси, зокрема вірус грипу, -є (-)-ланцюгом (~12 тис. нуклеотидів, іноді розділена на окремі фрагменти). Віруси використовують власну РНК-полімеразу для синтезу (+)-ланцюгів мРНК.
Віруси класу V! - ретровіруси, зокрема вірус імунодефіциту людини - містять два ідентичні (+)-ланцюги РНК (5-8 тис. нуклеотидів)
і використовують ДНК як проміжну стадію експресії спадкової інформації (рис. 5.9). У вірусній частинці є також два ферменти: зворотна транскриптаза (РНК-залежна ДНК-полімераза) та інтеграза. Зворотна транскриптаза здійснює в цитоплазмі клітини синтез комплементарного ланцюга ДНК із використанням вірусної РНК як матриці та молекули тРНК як праймера, після чого синтезує другий ланцюг ДНК. Дволанцюгова ДНК, що місить гени інтегрази, зворотної транскрип-тази, білків вірусної оболонки та довгі повтори на кінцях (LTR - long terminal repeats) у комплексі з інтегразою прямує до ядра, де інтеграза здійснює інсерцію цієї ДНК у геном. У такій формі провіруса вірусна ДНК може існувати в геномі досить довго. При активації транскрипції на провірусі клітинною РНК-полімеразою синтезується мРНК (що є одночасно вірусною (+)-РНК), відбувається трансляція та фор-мування вірусних частинок. Як правило, ретровірус не вбиває клітину: ДНК разом із провірусом передається дочірнім клітинам, які знову здатні утворювати вірусні частинки. Зрозуміло також, що завдяки активності ретровірусів є можливим перенесення частини генетичного матеріалу від одного організму до іншого.
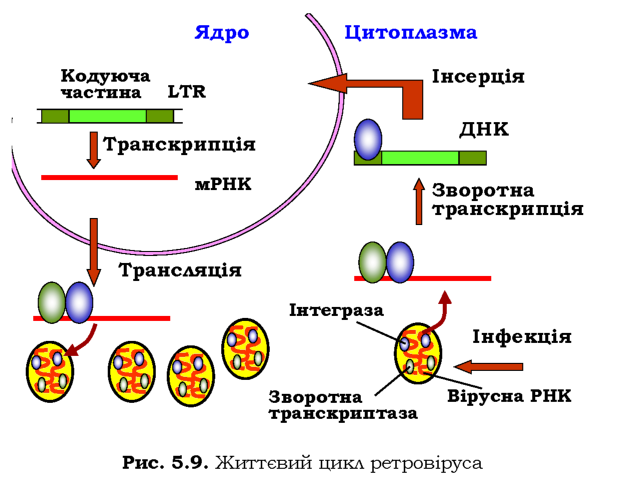
Віруси групи УІІ - ретроїдні віруси, до них належить і вірус гепатиту В, - містять дволанцюгову ДНК, вона використовується як матриця для синтезу мРНК, а також превірусної РНК (не показано на рис. 5.8). Ця остання є матрицею для синтезу вірусної ДНК за допомогою вірусної зворотної транскриптази.
Серед розмаїття одноклітинних еукаріотів, які можна розглядати як проміжний еволюційний щабель від прокаріотів до багатоклітинних організмів, зупинимося на двох прикладах. Перший стосується важливого для генетики експериментального об'єкта, другий - виду, що реалізує незвичайні перебудови свого спадкового апарату під час розвитку.
Дріжджі, з одного боку, - еукаріоти, з усіма притаманними їм особливостями (див. розділ 6). З іншого боку, це найпростіші з еукаріотів, що робить їх (у першу чергу, Saccharomyces cerevisiae) популярним модельним об'єктом дослідження в генетиці, молекулярній біології, біології клітини, а також у біотехнології - подібно до бактерій, дріжджі швидко розмножуються й досить легко піддаються культивуванню та трансформації (уведенню чужорідної ДНК, див. розділ 9).
Геном S. cerevisiae містить ~12 млн пар основ (16 хромосом у гаплоїдному наборі; крім хромосомної ДНК, дріжджі, подібно до бактерій, часто мають у своєму складі також автономні плазміди). Трохи більше 1 % геному становлять послідовності, що повторюються в цен-тромерних і теломерних зонах хромосом, дещо більше 2 % - мобільні елементи (так звані Ty-елементи, які відносять до класу LTR-ретро-позонів - див. розділ 6). Узагалі послідовності, що повторюються (включаючи гени рРНК і тРНК) дорівнюють ~10 % геному. На кодуючі послідовності ~6,7 тис. білкових генів припадає близько 70 % геному. Середній розмір кодуючої послідовності - 480 кодонів (варіює від 40 до 5 тис.). Тільки близько 3,5 % генів містять інтрони у своєму складі. Отже, геном S. cerevisiae є очевидною перехідною ланкою між геномами прокаріотів і вищих еукаріотів (див. табл. 1.1; розділ 6).
Цикл розвитку S. cerevisiae зображено на рис. 5.10. Диплоїдна клітина здатна розмножуватись брунькуванням: відбувається мітоз, поділ ядра, формування клітинної стінки та поділ клітин. В умовах нестачі поживних речовин здійснюється споруляція, коли диплоїдна клітина розділяється шляхом мейозу. Чотири гаплоїдні нащадки утворюють аскоспори, що інкапсулюються разом у структуру, яку називають аском. Споруляція є можливою тільки для диплоїдних клітин, гетерозиготних за локусом МАТ, - таких, що несуть два алелі цього локусу, які позначаються як МАТа й МАТа. Відповідно, утворюються гаплоїдні аскоспори двох типів: а та а.
Тип спори є так званим типом спарювання, або своєрідною "статтю" гаплоїдних клітин. При перенесенні аска на поживне середовище відбувається розмноження спор вегетативним шляхом, а також спарювання між "різностатевими" спорами з утворенням диплоїдної клітини. Використовуючи аски різних штамів, можна проводити схрещування між ними й досліджувати їхні результати методами генетичного аналізу. Для отримання "гібридних" штамів зазвичай використовують комплементарні генетичні маркери: наприклад, якщо клітини одного штаму не розмножуються на середовищі без триптофану, а іншого -потребують гістидин, то на відповідному середовищі можна відібрати "гібридні" диплоїдні колонії.
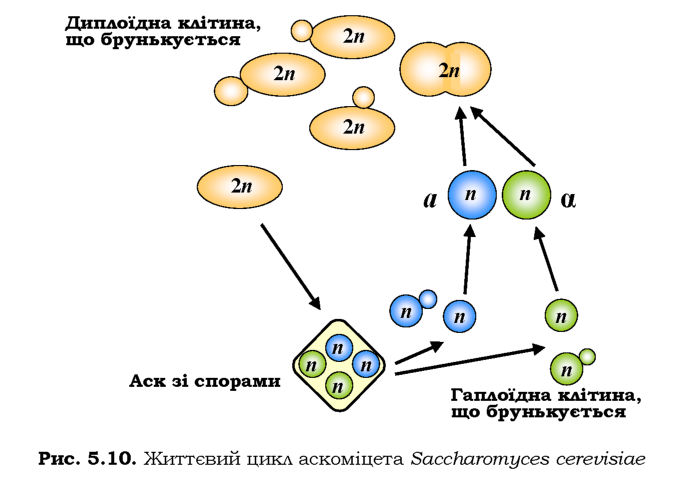
Якщо ізолювати окрему аскоспору, то її потомство, яке виникне за рахунок брунькування, має складатися з клітин одного типу. Проте такий штам не буде насправді моноспоровим, якщо в нього присутній ген НО, який забезпечує перемикання типів клітин: клітина а утворює бруньку типу а (або навпаки). Звичайно, у цьому випадку клітини різного типу, що накопичуються, будуть спарюватися з утворенням диплоїд-них гетерозигот, які врешті-решт і будуть переважати в культурі.
Перемикання типів клітин у S. cerevisiae є прикладом програмованої геномної перебудови. Локус МАТ розташований у правому плечі третьої хромосоми: елемент послідовності Yа або Ya, який визначає алельну форму локусу, фланкований кількома іншими елементами з обох боків (рис. 5.11, де зображено конфігурацію, що відповідає алелю МАТа). Поблизу від лівої та правої теломер є дві так звані касети, що являють собою алелі а та а відповідно. Але касети (позначаються як ИЫЬа та НМЬа) знаходяться у субтеломерних гетерохроматинових зонах, і тому не експресуються - вони недоступні для системи транскрипції внаслідок додаткової компактизації хроматину (див. розділ 6).
При перемиканні типів клітин спрацьовує ген НО, який кодує специфічну нуклеазу. Нуклеаза НО розрізає локус МАТ у зоні елемента Ya (або Ya). Наступні події еквівалентні схемі гомологічної рекомбінації (порівн. рис. 5.11 і 1.25): дволанцюговий розріз розширюється з утворенням двох 3'-кінцевих одноланцюгових хвостів, у хромосомі утворюється петля й гомологічна касета HMLa підводиться до зони розрізу, відбувається репараційний синтез ДНК на ланцюгах ДНК касети. Результатом є конверсія гена: заміна локусу МАТа на локус МАТа. Обидві касети при цьому залишаються в незмінному вигляді, і в майбутніх поколіннях ліва касета може бути використана для зворотного перемикання локусу МАТа на МАТа.
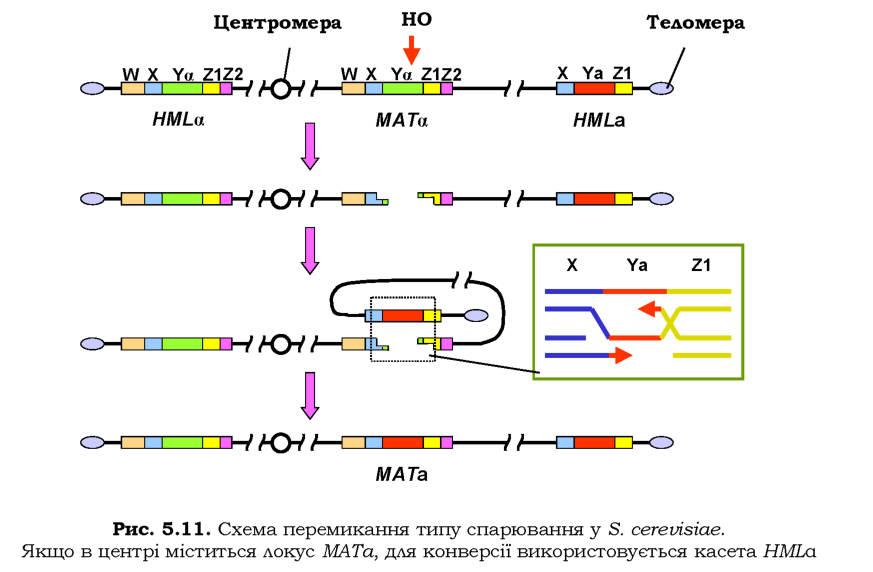
Результатом синтезу ДНК, що зображено на вставці рис. 5.11, буде утворення двох структур Холідея (порівн. рис. 1.26). Як пояснювалось у розділі 1, є два рівноймовірні шляхи розділення цих структур: із кросинговером між двома дуплексами та без (див. також рис. 1.28). У випадку, зображеному на рис. 5.11, кросинговер між двома дуплексами, що належать одній хромосомі, зумовить делецію - вирізання ділянки між локусом МАТ і касетою HMLа. Отже, у цьому разі спрямо-
вано реалізуються лише такі варіанти розділення, які не приводять до кросинговеру та, відповідно, хромосомних аберацій.
Слід зауважити, що й при міжхроматидній гомологічній рекомбінації не завжди кросинговер і конверсія без кросинговеру є рівно-ймовірними подіями. Так, при рекомбінації під час мітозу диплоїдних клітин дріжджів кросинговер відбувається лише в 10 % рекомбінаційних подій. Таким чином, принаймні в деяких випадках, процеси гомологічної рекомбінації можуть здійснюватися саме з метою конверсії геномної ділянки, яка б не супроводжувалась кросинговером.
Касетний механізм перемикання активності генів є досить поширеним: аналогічні процеси описано для інших видів аскоміцетів, трипаносом і деяких бактерій. Крім того, такий механізм напевно реалізується при внутрішньохромосомній гомологічній рекомбінації на генах, що тандемно повторюються (за принципом, який ілюструє рис. 5.11, і без кросинговеру), з метою підтримувати ідентичність тан-демних копій: мутація в одній з таких копій з високою імовірністю буде елімінована за рахунок використання іншої з багатьох нормальних гомологічних ділянок як матриці.
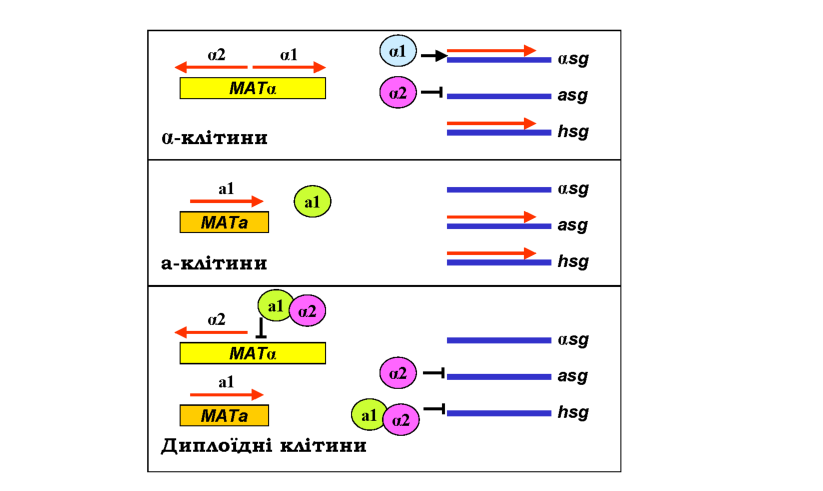
Повернемося до перемикання типів клітин у S. сeremsiae, яке є також добре вивченим прикладом взаємодії генів на рівні регуляції транскрипції. Приблизно по центру локусу МАТа розташована операторна ділянка, що активує два промотори, з яких відбувається транскрипція у двох протилежних напрямках. Продуктами цих генів є два білки а1 та а2 - транскрипційні фактори. Перший із них активує транскрипцію групи генів, які визначають специфічні ознаки клітин а-типу, другий -є репресором для групи а-специфічних генів (рис. 5.12). При цьому в гаплоїдних клітинах обох типів експресується група генів, специфічних для гаплоїдних клітин узагалі - за рахунок активації іншим фактором транскрипції. У клітинах а-типу з локусу МАТа експресується білок а1, який сам по собі не впливає на транскрипцію зазначених груп генів, але відсутність білків а1 і а2 зумовлює активацію а-специфічних (за відсутності репресора) і вимикання а-специфічних (за відсутності активатора) генів (рис. 5.12). У гетерозиготних за обома МАТ-локусами диплоїдних клітинах білок а1 утворює комплекс із а2, який ефективно блокує транскрипцію а1 (у результаті а-специфічні гени знову вимкнено), а також транскрипцію генів, специфічних для гаплоїдних клітин (рис. 5.12).
Крім того, комплекс а1-а2 є репресором гена НО, який не здатен ініціювати процес рекомбінації, зображений на рис. 5.11, у диплоїд-них клітинах. Активація цього гена в гаплоїдних клітинах потребує набору певних активаторів транскрипції, поява яких узгоджена з регуляцією клітинного циклу: вони з'являються тільки на пізній 01-стадії, коли й може розпочатися перемикання типів клітин.
 |
|
Рис. 5.12. Схема регуляції транскрипції в диплоїдних і гаплоїдних клітинах двох типів S. cerevisiae. Червоні стрілки - мРНК, овали -відповідні білкові продукти, які є факторами транскрипції груп генів, котрі специфічно виявляються в гаплоїдних клітинах узагалі (hsg), а-клітинах (asg) та а-клітинах (asg) |
Але регуляція активності гена НО є ще складнішою та не до кінця з'ясованою. Справа в тому, що після мітозу гаплоїдна спора продукує два типи клітин, які дещо розрізняються за властивостями, - так звані материнську та дочірню. Перемикання типів клітин відбувається тільки в материнській клітині, дочірня не здатна це робити, оскільки ген НО не активується. Отже, материнська клітина змінює свій тип -наприклад, а на а, і відбувається поділ з утворенням двох а-клітин, одна з яких знову є материнською і змінює свій тип на а, а інша - дочірньою, вона залишається клітиною а-типу.
Така асиметрія продуктів мітозу є характерною також для диференціації клітин багатоклітинних організмів, коли стовбурова клітина дає початок стовбуровій клітині та клітині, котра є більш спеціалізованою та такою, що втратила частину потенціалу розвитку. Розглянуті приклади відображають лише невелику частину вивчених для
S. cerevisiae генетичних механізмів, які допомагають з'ясувати загальні закономірності функціонування еукаріотичного апарату спадковості.
Генетичний апарат інфузорій відрізняється унікальною особливістю: у клітині присутні не одне, а два ядра - мікро- та макронуклеус. Перший із них містить диплоїдний набір хромосом (наприклад, у Tetrahymena thermophila п'ять пар хромосом), які є тільки сховищем спадкової інформації - гени мікронуклеуса не експресуються. У мак-ронуклеусі хромосомний набір є багатократно дуплікованим (кілька сотень хромосом), і саме гени макронуклеуса активно експресуються, але при цьому не передаються нащадкам.
При нестатевому розмноженні поділ мікронуклеуса здійснюється шляхом мітозу, а макронуклеуса - шляхом простого поділу, тобто з часом він старіє, і його активність знижується. Тоді між двома клітинами проходить статевий процес: відбувається кон'югація, під час якої макронуклеуси руйнуються, мікронуклеуси розділяються шляхом мейозу, і клітини обмінюються гаплоїдними ядрами - деталі процесу можуть розрізнятися для різних видів, але в результаті утворюються клітини, що мають по одному диплоїдному мікронуклеусу. Негайно після цього здійснюється його мітотичний поділ, і одне з дочірніх ядер перетворюється на макронуклеус.
Під час формування макронуклеуса геном не тільки багатократно дуплікується, а й піддається суттєвим перебудовам. Спочатку в складі ядра-попередника макронуклеуса проходять багатократні раунди реплікації ДНК - політенізація хромосом. Далі видаляються численні елементи послідовності ДНК (IES - internal eliminated sequences), розташовані всередині генів мікронуклеуса (таким чином, гени мікрону-клеуса, що перериваються IES, у принципі не можуть бути експресо-ваними). Після стикування кодуючих послідовностей генів здійснюється фрагментація хромосом на своєрідні мікрохромосоми - кожна має один або кілька генів і теломери на кінцях, які синтезуються те-ломеразою. Під час фрагментації хромосом видаляються також усі міжгенні зони, послідовності, що повторюються, і мобільні елементи -прибирається все беззмістовне "сміття". Загалом видаляється до 90 % геному. Нарешті, мікрохромосоми ампліфікуються в 4-6 раундах реплікації - процес дозрівання макронуклеуса завершується.
Геном макронуклеуса інфузорії Tetrahymena thermophila вже встановлено. Він містить 27 тис. генів - стільки ж, скільки у вищих еукаріотів (навіть трохи більше, ніж у людини). Унаслідок видалення значної частини ДНК загальний розмір геному (гаплоїдного набору) дорівнює 105 млн пар основ (у 30 разів менше, ніж у ссавців), вміст послідовностей, що повторюються становить ~2 %. Цікавою особливістю генетично-го апарату Tetrahymena є те, що кодони UAA та UAG (стоп-кодони для більшості організмів) кодують амінокислоту глутамін: тільки UGA використовується як стоп-кодон.
Незвичайна система функціонування спадкового апарату інфузорій ставить важливе фундаментальне питання: чому в еукаріотичних геномах зберігається велика кількість беззмістовної ДНК? При тому, що загальна структура геному інфузорії практично не відрізняється від такої вищих еукаріотів, реалізується механізм видалення беззмістовних послідовностей при утворенні макронуклеуса. Отже, ці послідовності не потрібні для експресії генетичної інформації. Проте ці "зайві" послідовності, як і в інших еукаріотів, ретельно зберігаються в мікронуклеусі й передаються нащадкам. У чому може полягати адаптивне значення такого збереження, залишається не зовсім зрозумілим. Утім, принаймні одна відповідь на це питання здається очевидною: беззмістовна ДНК є саме тією "обкладинкою", в якій зберігається змістовна ДНК, або своєрідним буфером, що захищає змістовний генетичний матеріал від пошкоджуючих впливів. Адже зовнішні мутагенні фактори імовірніше спрямовані на беззмістовну ДНК через те, що вона становить переважну більшість еукаріотичного геному.
Контрольні запитання і завдання
1. Яка різниця між бактеріальними штамами типів F+ і Hfr?
2. Якими шляхами здійснюється перенесення генетичного матеріалу між бактеріями?
3. На які класи можна поділити бактеріофаги за типом носія генетичної інформації?
4. Поясніть різницю між сайт-специфічною та гомологічною рекомбінацією. Яке функціональне значення має сайт-специфічна рекомбінація?
5. Опишіть життєвий цикл бактеріофага X. Від чого залежить вибір шляхів розвитку цього фага?
6. Яку функцію виконує репресор фага X? У чому полягає механізм його дії?
7. На які класи та за яким принципом поділяють еукаріотичні віруси?
8. Опишіть цикл розвитку ретровірусів.
9. Як відбувається розмноження Saccharomyces cerevisiae?
10. За яким механізмом здійснюється перемикання типів спарювання в S. cerevisiae?
11. У чому полягає структурна та функціональна різниця між макро-та мікронуклеусом у інфузорій?
Автор: admin от 18-07-2013, 16:56, Переглядів: 19653