Експресія генів
Першим етапом експресії генетичної інформації, записаної в послідовності нуклеотидів ДНК, є транскрипція - процес синтезу РНК з використанням одного з ланцюгів ДНК як матриці, тобто "переписування" послідовності нуклеотидів ДНК у послідовність нуклеотидів РНК.
Молекула РНК, що синтезується на білковому гені, - мРНК - використовується далі як джерело інформації на другому етапі експресії гена - синтезі білка, або трансляції, - перекладі нуклеотидного тексту в амінокислотний. Відповідність між цими двома типами текстів - між комбінаціями нуклеотидів і амінокислотами - називається генетичним кодом.
Безпосереднім продуктом активності геному, яка регулюється спеціальними системами (за участю певних генів), є специфічна для даного типу клітин сукупність транскриптів (молекул РНК) - транс-криптом. Участь цих транскриптів у білковому синтезі зумовлює утворення набору білків - протеому. Для цих білків характерною є складна взаємодія: за деякими оцінками, кожен білок протеому, наприклад дріжджів, вступає в середньому у п'ять таких взаємодій (не беручи до уваги гомотипних взаємодій між однаковими білковими субодиницями). Зважаючи на те, що білки вищих еукаріотів відрізняються наявністю більшої кількості структурних доменів у своєму складі, мережа білок-білкових взаємодій у протеомах організмів з вищою організацією має бути ще складнішою. Загальна картина взаємодій між білками (інтерактом) визначає розмаїття біологічних функцій, які часто й виконуються не поодинокими молекулами білків, а міжмолекулярними комплексами. При цьому варіації складу цих комплексів приводять до варіацій функціональних. Білки та мультимолекулярні комплекси, відповідні за каталіз хімічних реакцій, функціонування сигнальних мереж, транспорт сполук тощо, залучені до складної системи реакцій і метаболічних перетворень (реактом і метаболом), до якої зводиться вся сукупність зовнішніх ознак та фізіологічних проявів організму.
Сучасна генетика є ще досить далекою від остаточного розуміння цього складного шляху від системи генів до сукупності ознак. Однак принципи передачі інформації від гена до білка (а часто й далі) нині вже з'ясовані в багатьох деталях.
Генетичний код
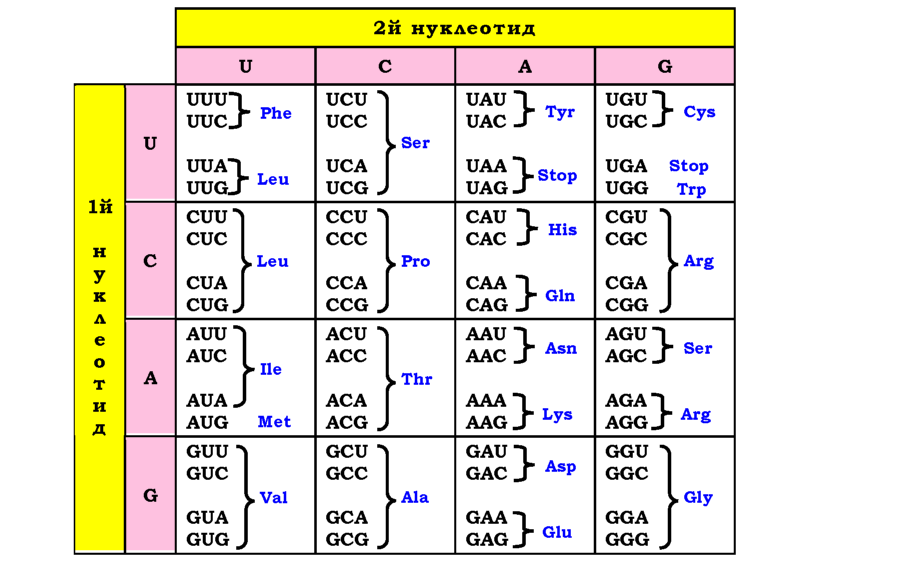
Одне "слово" нуклеотидного тексту має відповідати одному із 20 типів амінокислот, що входять до складу білків. Загальна кількість комбінацій по два нуклеотиди з чотирьох дорівнює 16, а по три - 64. Отже, мінімальна кількість нуклеотидів у одному слові, достатня для кодування 20 амінокислот, має дорівнювати трьом. Саме це й реалізується в генетичному коді: одне слово - кодон - являє собою триплет нуклеотидів (рис. 2.1). Серед 64 кодонів три є сигналами зупинки синтезу білка (стоп-кодони, або нонсенс-кодони), решта (61 змістовний кодон) відповідають 20 амінокислотам. Певний триплет кодує одну й тільки одну певну амінокислоту. Зворотне співвідношення не є однозначним: 18 амінокислот кодуються кількома синонімічними триплетами - код є виродженим. Дві амінокислоти - Trp і Met - невироджені й кодуються лише одним кодоном кожна.
Три позиції нуклеотидів у складі синонімічних кодонів не рівнозначні: найважливішою для визначення змісту кодона є комбінація нуклеотидів у першій та другій позиції. При цьому друга позиція визначає зміст кодона найжорсткіше - нуклеотидні заміни по ній завжди приводять до зміни змісту (амінокислотної заміни). Найне-змістовнішою є третя позиція - нуклеотидні заміни по третій позиції в 70 % випадків не викликають змін змісту кодона.
Два параметри амінокислотних залишків мають особливе значення для структури білка: розмір і здатність взаємодіяти з водою. За останньою ознакою залишки можна розділити дві групи: полярні
(такі, що добре взаємодіють із водою, - Arg, Asn, Asp, Gln, Glu, His, Lys, Ser, Thr) і неполярні, або гідрофобні (Cys, Ile, Leu, Met, Phe, Trp, Tyr, Val). Три гідрофобні залишки (Ala, Gly, Pro) - маленького розміру, тому їх можна вважати "нейтральними" щодо спорідненості до води. У глобулярних водорозчинних білках співвідношення між гідрофобними й полярними залишками дорівнює в середньому 50 : 50. Унаслідок гідрофобного ефекту неполярні залишки прагнуть опинитися всередині структури білка, полярні залишаються на поверхні, зберігаючи взаємодії з водою. Це і є головна рушійна сила, яка змушує білковий ланцюг укладатися певним чином у просторі, формуючи компактну глобулярну структуру, що має певну функціональну активність.
 |
|
Рис. 2.1. Таблиця генетичного коду. Послідовності кодонів наведено у напрямку від 5'- до З'-кінця у складі мРНК. Використано стандартні скорочення амінокислот (у дужках - загальновживані однолітерні скорочення): Ala - аланін (A), Arg - аргінін (R), Asn - аспарагін (N), Asp - аспарагінова кислота (D), Cys - цистеїн (C), Gln - глутамін (Q), Glu - глутамінова кислота (E), Gly - гліцин (G), His - гістидин (H), Ile - ізолейцин (I), Leu - лейцин (L), Lys - лізин (K), Met - метіонін (M), Phe - фенілаланін (P), Pro - пролін (P), Ser - серин (S), Thr - треонін (T), Trp - триптофан (W), Tyr - тирозин (Y), Val - валін (V). Stop - стоп-кодон |
Залежно від типу нуклеотиду в другій позиції, усі кодони можна розділити на чотири групи (чотири стовпчики в таблиці коду на рис. 2.1). До групи U (урацил у другій позиції) належать гідрофобні амінокислоти великого розміру, до групи А - великі полярні амінокислоти (крім Tyr, але й він, хоча загалом гідрофобний, також здатен утворювати водневий зв'язок), група С сформована амінокислотами маленького розміру. Тобто нуклеотидні заміни в першій і третій позиціях у межах цих груп не викликають зміни властивостей амінокислоти, мінімізуючи вплив таких амінокислотних замін на просторову структуру білка: генетичний код є стійким до перешкод.
Наведена таблиця коду реалізується як для бактерій, так і для ссавців, тобто генетичний код досить універсальний. Але в деяких випадках (окремі прокаріоти, гриби, водорості, а також автономна генетична система мітохондрій) спостерігаються невеличкі відхилення від цієї універсальної таблиці. Наприклад, деякі стоп-кодони іноді стають змістовними. Слід зауважити також, що один із стоп-кодонів -UGA - у переважної більшості організмів використовується для кодування мінорної 21-ї амінокислоти - селеноцистеїну. Ця амінокислота включається при білковому синтезі лише в кілька важливих ферментів, таке нестандартне сприйняття стоп-кодона системою трансляції залежить від контексту послідовності, в якому цей кодон міститься.
У процесі синтезу білка триплети зчитуються з нуклеотидного тексту один за одним: сусідні триплети не перекриваються, між ними немає проміжків. Будь яка послідовність нуклеотидів може бути прочитана трьома різними способами, тобто вона містить три рамки зчитування (рис. 2.2). Нуклеотидна заміна може зумовити зміну змісту кодона - амінокислотну заміну, а видалення хоча б одного нуклеотиду привести до зсуву рамки зчитування, тобто заміни змісту всіх кодо-нів, розташованих нижче такого втраченого нуклеотиду (чи ділянки, довжина якої не є кратною трьом).
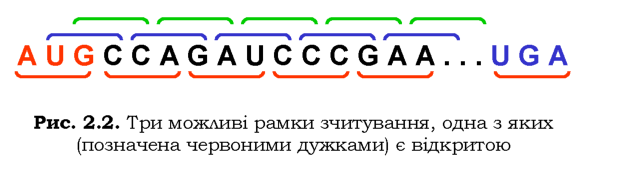
Рамка, яка розташована між стартовим (найчастіше роль стартового при білковому синтезі відіграє метіоніновий кодон AUG) і стоп-кодоном, називається відкритою рамкою зчитування (ORF, open reading frame). Отже, кодуюча частина білкового гена обов'язково містить відкриту рамку зчитування.
Синтез білків
Молекулярні механізми білкового синтезу в основному є спільними для всіх живих організмів. Зчитування інформації, записаної в послідовності нуклеотидів мРНК, та 'її переклад у амінокислотний текст розпочинається зі стартового кодона, де при ініціації трансляції відбувається остаточне збирання головного пристрою трансляції -рибосоми - комплексу рибосомної РНК і білків. Вона сканує нуклео-тидну послідовність мРНК, рухаючись уздовж неї кроками по три нуклеотиди від 5'- до З'-кінця під час елонгації трансляції до стоп-кодона, де відбувається термінаця процесу. Під час сканування рибосома працює як декодуючий пристрій, забезпечуючи впізнання кодонів комплементарними щодо них триплетами (антикодонами) у складі тРНК (транспортні РНК), і як каталізатор процесу синтезу пептидного зв'язку між амінокислотами. Певний антикодон відповідає амінокислоті певного типу, яку несе на собі тРНК. Отже, тРНК є ключовою ланкою реалізації генетичного коду: саме вони забезпечують доставку амінокислот до рибосоми в порядку, який відповідає послідовності кодонів.
Молекули тРНК містять 74-95 (найчастіше 76) нуклеотидів.
У складі молекули формуються комплементарні дволанцюгові стебла та шпильки з петлями на кінцях за єдиною для всіх тРНК схемою (рис. 2. З). Кінцеві фрагменти ланцюга об'єднуються у дволанцюгове стебло, причому чотири нуклеотиди на З'-кінці залишаються неспаре-ними. З'-Кінцевий триплет ССА є стандартним для всіх тРНК, до рибози кінцевого аденозину ковалентно приєднується амінокислота -відповідно, стебло називають акцепторным.
 |
|
Рис. 2.3. Схема та просторова структура тРНК Зображення створено за допомогою програми PyMOL, код структури у Protein Data Bank 6TNA. Елементи структури пофарбовані однаково ліворуч і праворуч |
Чотири дволанцюгові стебла попарно переходять одне в одне й формують дві приблизно перпендикулярні одна одній подвійні спіралі (рис. 2.3). У результаті молекула тРНК має Г- або L-подібну форму з двома плечима різної довжини: на кінці одного плеча акцептується амінокислота (акцепторне плече), на кінці іншого - у складі антико-донової петлі - розташований антикодон (антикодонове плече).
тРНК конкретного типу, яка відповідає певній амінокислоті, позначають, індексами, наприклад, тРНКА1а. Якщо молекула тРНК містить амінокислоту, то таку аміноацил-тРНК позначають як А1а-тРНКА1а. Загальне позначення для аміноацильованих тРНК - аа-тРНК.
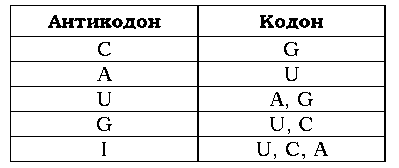
Молекули тРНК є продуктами транскрипції відповідних генів, частина яких представлена кількома копіями, - близько 500 активних генів тРНК у геномі людини, 87 у геномі E. coli Загальна кількість типів тРНК, які обслуговують процес білкового синтезу, становить близько 40 (наприклад, усі гени тРНК людини можна розділити на 49 родин за властивостями антикодонів). Оскільки типів тРНК більше, ніж амінокислот, одній амінокислоті може відповідати кілька тРНК - такі тРНК називають ізоак-цепторними Типів тРНК менше, ніж кодонів, тому одна тРНК здатна розпізнавати кілька синонімічних кодонів, що забезпечується неоднозначністю спарювання між першою позицією антикодона і третьою
(за якою в основному розрізняються синонімічні кодони (рис. 2.1)) - кодона. А саме: U та G здатні впізнавати по два нуклеотиди у третій позиції кодона, I (інозин - неканонічна азотиста основа, що досить часто зустрічається в першій позиції антикодона) упізнає три нуклеотиди (табл. 2.1).
|
Таблиця 2.1. Відповідність між нуклеотидами у першій позиції антикодона і третій позиції кодона |
 |
Порядок залучення амінокислот до поліпептидного ланцюга, який утворюється при білковому синтезі, залежить лише від взаємодій між нуклеїновими кислотами - кодоном і антикодоном; амінокислота, яку несе тРНК, жодним чином не розпізнається рибосомою. Отже, акцептування певної амінокислоти молекулою тРНК відповідного типу (і тільки відповідного) є одним із найважливіших моментів білкового синтезу: від точності процесу акцептування буде залежати й точність синтезу білка в цілому. Процес приєднання амінокислот до тРНК каталізується аміноацил-тРНК-синтетазами (АРСаза). Кожна із 20 типів (за кількістю амінокислот) цих ферментів є прецизійним молекулярним пристроєм, який забезпечує високоточне (середня частота помилок становить приблизно 10-6) акцептування амінокислот відповідними тРНК.
Рибосома й механізм трансляції
Рибосома - рибонуклеопротеїновий комплекс, який складається з двох субодиниць. Маленька субодиниця прокаріотичної рибосоми містить одну молекулу рРНК 16S (компоненти рибосоми прийнято позначати їхніми коефіцієнтами седиментації у сведбергах - S) і 21 молекулу рибосомних білків. Велика субодиниця містить дві молекули рРНК (23S і 5S) і білки 36 типів. Еукаріотична рибосома містить трохи більшу рРНК 18S замість 16S, дві рРНК (28S і 5,8S), замість 23S, рРНК 5S і більшу кількість білків. Структура обох рибосом і принципи їхньої роботи подібні.
Синтез еукаріотичних рРНК 18S, 5,8S і 28S здійснюється в ядерці, яке формується на тандемних повторах кластера відповідних генів рРНК (кластер повторюється від 100 до 1000 разів у різних видів).
Первинний продукт транскрипції містить три фрагменти майбутніх рРНК, розділені спейсерами, - кластер транскрибується як одне ціле. Процесинг рРНК - деградація спейсерів, а також певні хімічні модифікації - здійснюється за участю близько 150 типів маленьких ядерцевих РНК (аналогічно до того, як маленькі ядерні РНК беруть участь у проце-сингу мРНК, про що йтиметься нижче). Гени рРНК ще одного типу - 5S -також тандемно повторюються в іншому місці геному, звідки рРНК 5S транспортуються до ядерця, куди потрапляють також і рибосомні білки, і де відбувається збирання рибосомних субодиниць. Первинний продукт транскрипції прокаріотичних генів рРНК містить ділянки, які відповідають усім трьом прокаріотичним рРНК, а також кілька майбутніх тРНК. Часткова деградація транскрипту приводить до утворення зрілих молекул, які взаємодіють із рибосомними білками, формуючи дві суб-одиниці рибосоми. Остаточне збирання рибосоми з двох субодиниць, як у про-, так і в еукаріотів, відбувається під час ініціації трансляції.
Рибосомні РНК становлять близько 2/3 маси рибосоми й саме вони визначають 'її структуру та функції. Полінуклеотидний ланцюг рРНК утворює велику кількість подвійних спіралей, які укладаються в складну просторову структуру. Рибосомні білки розташовані на поверхні рРНК (і, відповідно, на поверхні рибосоми), стабілізуючи 'її функціонально активну просторову організацію.
Під час роботи рибосоми 'її маленька субодиниця взаємодіє з мРНК. Сумісно двома субодиницями утворюються сайти зв'язування для трьох молекул тРНК (рис. 2.4): А-сайт - у ньому відбувається зв'язування аа-тРНК; Р-сайт - тут із рибосомою взаємодіє пептидил-тРНК (тРНК, до якої приєднаний пептидил - ланцюг, що синтезується); Е-сайт (від exit) - куди потрапляє деаміноацильована тРНК перед її звільненням із рибосоми.
Зчитування інформації з мРНК здійснюється рибосомою в напрямку від 5'- до 3'-кінця, поліпептидний ланцюг синтезується від N- до С-кінця. Процес трансляції розпочинається зі стадії ініціації (рис. 2.4), коли рибосомою впізнається стартовий кодон, що задає початок і рамку зчитування інформації. На нього та в Р-сайт рибосоми одночасно завантажується ініціаторна аа-тРНК. Ефективність здійснення цих операцій забезпечується набором певних білкових факторів ініціації.
Стартовим кодоном є здебільшого метіоніновий кодон AUG, відповідно, ініціаторною є завжди Мє^тРНК^1 (індекс "і" вказує на те, що це -саме ініціа.торна метіонінова тРНК, тобто вона відрізняється за своєю структурою від звичайної тРНКМєі, яка використовується для включення Met усередині ланцюга). Отже, першою амінокислотою завжди виступає метіонін (як правило, відщеплюється посттрансляційно).
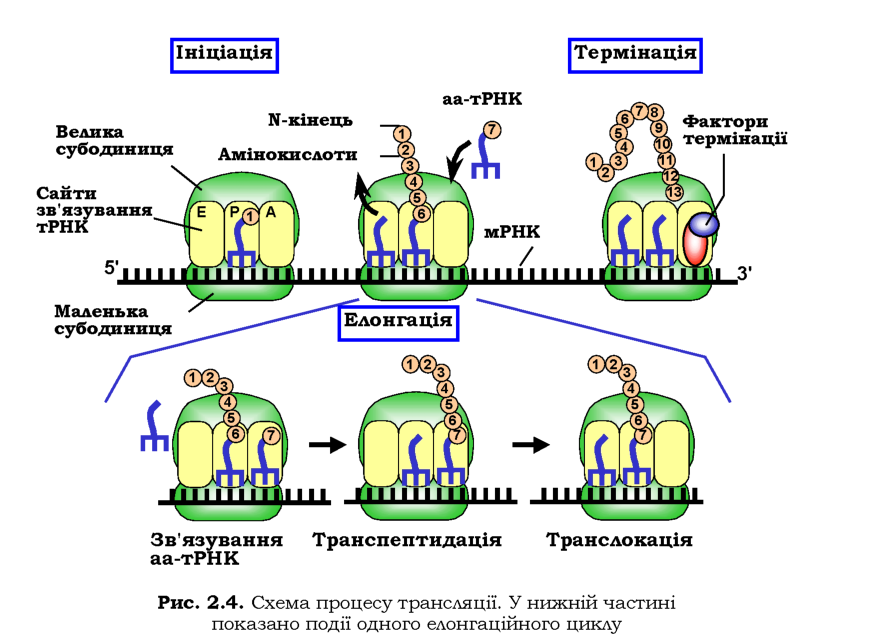
Далі робота рибосоми під час елонгації трансляції полягає в послідовному (потриплетно) зчитуванні інформації з мРНК і відповідному приєднанні амінокислот до поліпептидного ланцюга (рис. 2.4). Кожен такий крок складається з трьох операцій, що циклічно повторюються (елонгаційний цикл). Цикл розпочинається зі зв’язування аа-тРНК з А-сайтом. Рибосома забезпечує високу специфічність щодо взаємодій між кодоном і антикодоном - тільки споріднена до даного кодона тРНК відбирається системою. Процес розміщення аа-тРНК в А-сайті часто супроводжується дисоціацією з Е-сайта деаміноацильованої тРНК, яка залишилася там із попереднього циклу.
Наслідком зв'язування є транспептидація - перенесення пептидилу з пептидил-тРНК на амінокислоту у складі аа-тРНК. Каталітичний активний центр, що забезпечує транспептидацію, розташований на великій субодиниці рибосоми й формується виключно рибосомною РНК. Унаслідок транспептидації в А-сайті опиняється пептидил-тРНК із подовженим на одну амінокислоту пептидилом, у Р-сайті - деаміноацильована тРНК.
Третя операція - транслокація - полягає в переміщенні рибосоми на один кодон уздовж мРНК (молекули тРНК залишаються зв'язаними зі своїми кодонами), після чого розпочинається наступний елонгацій-ний цикл. Ефективніть і швидкість здійснення елонгаційного циклу залежить від двох білкових факторів елонгації.
Коли після чергового елонгаційного циклу (який стане останнім) в А-сайті опиняється один із трьох стоп-кодонів, він розпізнається факторами термінації трансляції - жодна тРНК не містить відповідних антикодонів (рис. 2.4). Фактори термінації забезпечують звільнення синтезованого амінокислотного ланцюга та підготовку рибосоми до нового раунду трансляції: дисоціацію субодиниць рибосоми одна від одної та від мРНК.
Експресія генів у прокаріотів
Розглянемо перший етап експресії гена - транскрипцію - і, водночас, загальну картину реалізації спадкової інформації. Хоча молекулярні механізми синтезу РНК є значною мірою спільними для всіх живих організмів, вони суттєво розрізняються для про- та еукаріотів. Тому варто розглянути їх окремо, а почати слід із простішої прокаріо-тичної системи експресії генів.
Зростання ланцюга РНК при транскрипції відбувається в напрямі від 5'- до З'-кінця. Субстратами реакції є З'-кінцева ОН-група рибози зростаючого транскрипту (ланцюга РНК, що синтезується) і рибонук-леозидтрифосфати (rNTP). Принципова схема реакції ідентична схемі реакції синтезу ДНК (рис. 1.16) - приєднання чергового нуклеотиду залежить від його комплементарних взаємодій з тим ланцюгом ДНК, котрий використовується як матриця. Фермент, який каталізує цю реакцію - ДНК-залежна РНК-полімераза.
До складу бактеріальної РНК-полімерази входять кілька білкових субодиниць. Залежно від стадії транскрипції існує дві 'її форми:
1) кор-фермент у складі субодиниць, позначуваних як а (дві копії), в, в' і ы;
2) голофермент - комплекс кор-ферменту із субодиницею о.
Кор-фермент може працювати на різноманітних послідовностях, оскільки має досить високу неспецифічну спорідненість до ДНК. Поява субодиниці о у складі голоферменту зумовлює зниження загальної неспецифічної спорідненості, однак при цьому виникає специфічна спорідненість до промоторів - особливих ділянок, із яких має розпочинатися транскрипція. Субодиниця о, таким чином, виконує роль загального фактора ініціації транскрипції. Різні промотори розрізняються за спорідненістю до голоферменту (силою промотора). Відповідно, упізнання слабких промоторів залежить від додаткових, специфічних для даного гена чи групи генів, факторів ініціації.
Робочий цикл РНК-полімерази складається з таких стадій.
• Ініціація транскрипції, яка також є багатостадійним процесом (рис. 2.5):
1) зв'язування голоферменту з промотором;
2) локальне плавлення подвійної спіралі - розходження ланцюгів ДНК (на ділянці у 12-14 пар основ), яке дозволяє використовувати один із них як матрицю;
3) включення перших двох нуклеотидів у молекулу РНК (синтез першого фосфодіефірного зв'язку в активному центрі поліме-рази) є найповільнішою стадією процесу, яка може відбуватися тільки у присутності субодиниці о;
4) зростання первинного короткого транскрипту - приєднання 8-9 нуклеотидів;
5) очищення промотора - дисоціація о-фактора, яка маркує перехід до елонгації транскрипції.
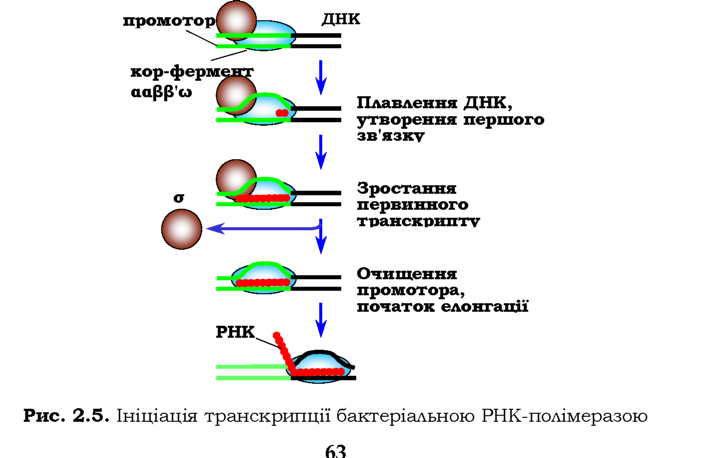
• Елонгація транскрипції, у кожному елементарному акті якої приєднується черговий нуклеотид до 3'-кінця РНК і кор-фермент пересувається на один нуклеотид уздовж матриці. При цьому разом із полімеразою переміщується також і розплавлена ділянка ДНК: одна пара основ руйнується попереду від полімерази, одна - відновлюється позаду. Синтез РНК відбувається із середньою швидкістю 40 нуклеотидів за секунду.
• Термінація транскрипції - визволення транскрипту, після чого кор-фермент знову взаємодіє з о-субодиницею і здійснює новий пошук промотора. Сигнал термінації являє собою послідовність, транскрипція якої приводить до утворення у складі мРНК комплементарної дволанцюгової шпильки, безпосередньо фланкованої polyU послідовністю: цей елемент структури мРНК розпізнається полімеразою, унаслідок чого система руйнується. Іноді процес полегшується додатковими білковими факторами термінації.
РНК-полімераза характеризується асиметричною структурою: дві великі субодиниці - в і в' - формують характерні "щелепи", із внутрішньою поверхнею яких взаємодіє ДНК, розташована "нижче" (downstream) у напрямку руху полімерази. Глибоко між щелепами міститься каталітичний активний центр (рис. 2.6). Ці риси структурної організації є загальними для всіх інших РНК-полімераз: еукаріотич-них і мономерних полімераз деяких бактеріофагів.
5" РНК
Матричний
^NTP
Рис. 2.6. Схема організації РНК-полімеразного комплексу (у розрізі) під час елонгації транскрипції
Асиметрична будова РНК-полімерази зумовлює два можливі способи, якими фермент може бути орієнтованим відносно ДНК: кожній із цих орієнтацій буде відповідати два протилежні напрямки руху при транскрипції. Відповідно, один із двох ланцюгів ДНК буде обиратися як матричний - той, з якого зчитується інформація у напрямку 3'-5' (рис. 2.6, 2.7). Послідовність ланцюга ДНК, який є комплементарним матричному, збігається з послідовністю РНК, що синтезується. Тому саме цей нематричний ланцюг називають кодуючим, або змістовним, -його послідовність прийнято наводити як послідовність даного гена (відповідно, матричний ланцюг називають антикодуючим). Нуклеотид кодуючого ланцюга, який відповідає стартовому нуклеотиду РНК (частіше пуриновий), позначається як +1, наступні нуклеотиди (чи пари основ) у напрямку руху полімерази нумерують з позначкою "+": +2, +3 і т. д. У зворотному напрямку (ліворуч на рис. 2.7) нуклеотиди нумерують із позначкою "-" (починаючи з -1).
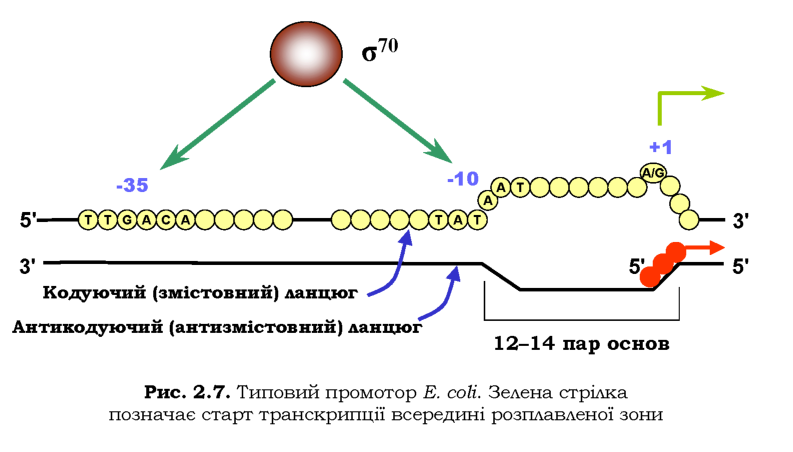
Типовий бактеріальний промотор (рис 2.7) складається з двох елементів послідовності, розташованих на відстані приблизно -10 і -35 від стартової точки. Консенсусна (узагальнена для різних промоторів) послідовність елемента -35 має вигляд T82T84G78A65C54A45 (числами позначено частоту зустрічальності даної основи у відсотках). Послідовність елемента -10 (називається також боксом Прибноу):
T80A95T45A60A50T96. Варіабельність послідовностей визначає різну ефективність ініціації - силу промоторів. Саме елементи -35 та -10 безпосередньо впізнаються о-фактором при ініціації транскрипції. Наведені послідовності розпізнаються варіантом о-фактора із молекулярною вагою 70 кДа (о70), який є досить широко застосовуваним, однак він не єдиний. Кільком іншим варіантам о, під контролем яких перебувають певні групи промоторів, відповідають інші консенсусні послідовності -35 та -10. Взаємодія о-фактора з промотором чітко орієнтує РНК-полімеразу щодо ДНК, тобто визначає як стартову точку транскрипції, так і її напрямок (вибір одного з двох ланцюгів як матричного).
Суттєвою особливістю прокаріотичної системи транскрипції білкових генів є те, що молекула мРНК зв'язується з рибосомами безпосередньо під час транскрипції - прокаріотична транскрипція і білковий синтез є єдиним процесом. При цьому мРНК, що синтезується на так званих оперонах - кластерах кількох генів, про які детальніше йтиметься нижче, містить кілька послідовних рамок зчитування та кілька стартових кодонів. Ініціація трансляції відбувається окремо на кожному з них усередині мРНК, і розпізнання цих стартових кодонів не залежить від їхнього розташування щодо 5'-кінця матриці (так звана внутрішня ініціація). Специфічне розміщення стартового кодона в Р-сайті рибосоми при ініціації трансляції у прокаріотів забезпечується комплементарним упізнанням між ділянкою рРНК 16S і консервативною послідовністю Шайна - Дальгарно, розміщеною в мРНК за 5-9 нуклеотидів від стартового кодона в напрямку до 5'-кінця. Саме наявність цієї послідовності й робить даний кодон AUG стартовим, відрізняючи його від звичайного метіонінового кодона.
Якщо рибосоми з тих чи інших причин не зв'язуються з мРНК, транскрипт швидко деградує під дією нуклеаз.
Зрозуміло, що гени не транскрибуються постійно, а вмикаються / вимикаються в певні моменти залежно від зовнішніх умов, стадій клітинного циклу тощо. Головними елементами, взаємодія між якими зумовлює активацію чи репресію транскрипції, є цис- і транс-елементи. Цис-елементи - це регуляторні елементи послідовності ДНК, які фізично зв'язані з даним геном; у прокаріотів часто називаються операторами і перебувають у безпосередній близькості до промоторів. Транс-елементи - білкові фактори транскрипції, які вільно дифундують (транспортуються) у просторі клітини, шукаючи свій цис-елемент, до якого вони мають специфічну спорідненість. Якщо зв'язування транс-елемента з оператором приводить до активації транскрипції (часто за рахунок прямих білок-білкових взаємодій транскрипційного фактора з РНК-полімеразою, які підвищують 'її спорідненість до про-мотора), кажуть, що фактор є активатором і здійснює позитивну регуляцію. Якщо фактор блокує зв'язування РНК-полімерази (часто за рахунок зниження доступності промотора), його називають репресором і йдеться про негативну регуляцію.
Ці загальні принципи регуляції, які, ускладнюючись, зберігаються також в еукаріотів, реалізуються на стадії ініціації. Крім того, для регуляції використовуються інші моменти процесу транскрипції. Зокрема, для регуляції певних генів застосовується механізм антитермінації, коли активатори транскрипції запобігають упізнанню РНК-полі-меразою сигналів термінації, що містяться всередині кодуючої частини гена. Якщо фактори відсутні, ген неактивний: наявність термінуючого сигналу зумовлює термінацію транскрипції та визволення нефункционального РНК-продукту.
Суттєвою особливістю прокаріотичного геному є те, що хоча приблизно 3/4 транскрипційних одиниць (скажімо, E. coli) містять один ген, решта реалізує характерний для бактерій оперонний принцип організації генетичного матеріалу. Оперон являє собою кластер так званих структурних генів, на яких синтезується одна молекула мРНК, що має кілька (одна на кожен структурний ген) послідовних відкритих рамок зчитування для трансляції відповідних білків. У межах оперона згруповані структурні гени, які відповідають за синтез білків, залучених до одного ланцюжка біохімічних перетворень (ферменти синтезу або деградації певної сполуки). Крім структурних генів оперон має регуляторні ділянки, за рахунок яких здійснюється регуляція транскрипції оперона як цілого. У геномі E. coli міститься ~650 таких одиниць транскрипції.
Наступні два приклади ілюструють найтиповіші механізми регуляції транскрипції у прокаріотичних системах.
Лактозний оперон (lac-оперон) E. coli став свого часу, завдяки дослідженням Жакоба і Моно (Francois Jacob, Jacques Monod), першою детально вивченою системою регуляції транскрипції. До складу опе-рона (рис. 2.8) входять три структурні гени, що кодують ферменти, залучені до утилізації (катаболізму) лактози. Транскрипція всіх трьох генів здійснюється з одного промотора (синтезується єдина поліцист-ронна молекула мРНК, яка має три послідовні відкриті рамки зчитування). Промотор оточують дві однакові операторні ділянки (lac-опе-ратори), що мають спорідненість до lac-репресора, і сайт зв'язування CAP (Catabolite Activator Protein).
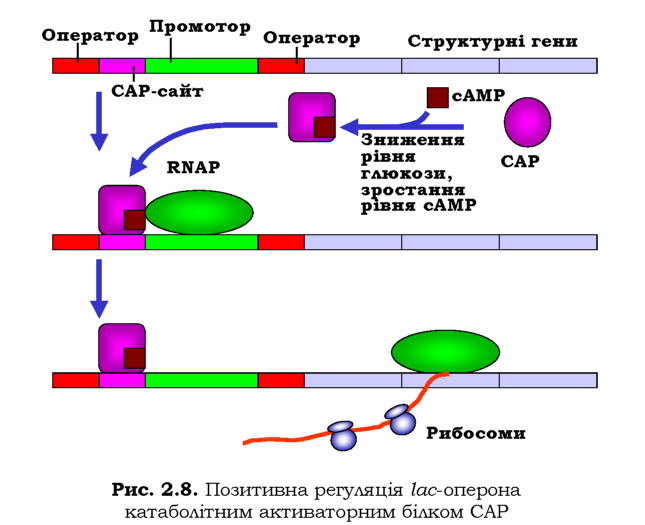
Промотор Zac-оперона слабкий - у нього досить низька власна спорідненість до РНК-полімерази. Навіть якщо в середовищі є лактоза, але присутня також глюкоза (кращий харчовий субстрат для бактерій), транскрипція Zac-оперона майже не здійснюється. Зниження рівня глюкози приводить до підвищення внутрішньоклітинної концентрації сАМР (циклічного аденозинмонофосфату), зв'язування якого з САР індукує конформаційну перебудову білка та появу його специфічної спорідненості до відповідного сайта на ДНК (див. структуру комплексу на рис. 1.7, в). Взаємодія САР із РНК-полімеразою підсилює 'її спорідненість до промотора - САР рекрутує полімеразу, яка далі розпочинає синтез мРНК (рис. 2.8).
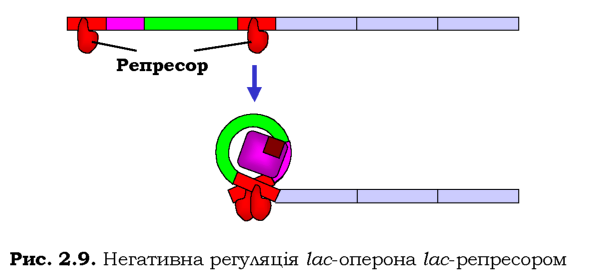
Описаний сценарій позитивної регуляції реалізується лише за умови, що Zac-оператори не взаємодіють із Zac-репресором. У разі відсутності лактози (коли відповідні ферменти 'її утилізації напевно не потрібні) гомодимери репресора (незалежно від можливої присутності САР) зв'язуються з обома операторами й при цьому взаємодіють між собою: утворюється тетрамерний комплекс, який утримує петлю ДНК (рис. 2.9). Усередині петлі міститься промотор, і це абсолютно запобігає зв'язуванню з ним РНК-полімерази. Коли з'являється лактоза, 'її невелика кількість перетворюється на алолактозу, яка спрацьовує як індуктор Zac-оперона: зв'язування алолактози з репресором індукує структурні зміни білка та втрату його спорідненості до оператора. Унаслідок руйнування петлі РНК-полімераза зв'язується з промотором і оперон починає працювати.
Атенюація. Система атенюації (attenuation - послаблення), яка використовується зокрема для регуляції активності триптофанового оперона (ігр-оперона) E. coli, пов'язана із використанням сигналів термі-нації та тієї обставини, що прокаріотична транскрипція тісно узгоджена з трансляцією. Триптофановий оперон містить п'ять структурних генів, які відповідають за синтез амінокислоти Trp, перед ними розташовані промотор, оператор і лідерна послідовність, з якої розпочинається транскрипція (рис. 2.10, а).
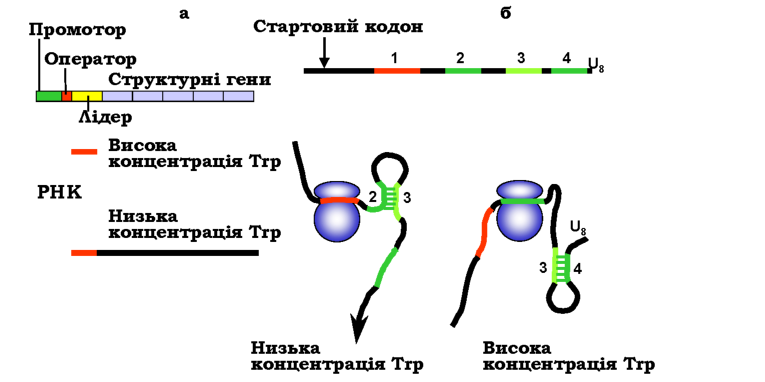 |
|
Рис. 2.10. (а): Схема ігр-оперона, на якому синтезуються два РНК-продукти залежно від внутрішньоклітинної концентрації Trp. (б): Лідерна РНК і два варіанти спарювання основ у її складі залежно від розташування рибосоми |
Лідерна частина РНК містить стартовий кодон, що розпізнається рибосомою, і чотири елементи послідовності: ділянка 1 містить два послідовні триптофанові кодони, ділянки 2-3 та 3-4 є попарно взаємо-комплементарними, за ділянкою 4 розташована оліго-U послідовність. Шпилька 3-4, фланкована оліго-U, є, таким чином, сигналом термі-нації транскрипції. Коли концентрація Trp низька (є потреба у Trp і тому оперон має бути активним), рибосома зупиняється на трипто-фанових кодонах ділянки 1 (оскільки відсутня і Trp-тРНК). У цьому випадку утворюється шпилька 2-3 (ділянка 3 не залучається до утворення термінуючої шпильки) і РНК-полімераза продовжує синтез повноцінної мРНК. Рибосоми зв'язуються зі стартовими кодонами, що відповідають структурним генам, і синтезуються відповідні білки.
За високого рівня Trp рибосома швидко проходить через ділянку 1 на ділянку 2 і зупиняється на стоп-кодоні. У результаті утворюється шпилька 3-4, тобто формується сигнал термінації, і РНК-полімераза зупиняє транскрипцію після синтезу короткої нефункціональної лідерної РНК.
trp-Оперон перебуває також під контролем trp-репресора. Регулятором спорідненості репресора до оператора є сам Trp: у комплексі з ним репресор набуває конформаційної форми, яка має високу спорідненість. Якщо концентрації Trp знижується - репресор дисоціює й ефективність ініціації транскрипції підвищується приблизно в 70 разів. Атенюація є додатковим, менш ефективним механізмом регуляції: у разі відсутності Trp ефективність транскрипції підвищується приблизно в 10 разів за рахунок атенюації (за наявності Trp близько 10 % РНК-полімераз долають сигнал термінації й продовжують працювати, за відсутності Trp - практично всі). Таким чином, сумісна дія атенюа-ції та негативного контролю за рахунок репресора дозволяє змінювати активність оперона майже в 700 разів залежно від внутрішньоклітинної концентрації Trp.
Експресія генів в еукаріотів
На відміну від прокаріотів, еукаріотична мРНК синтезується під час транскрипції у клітинному ядрі, звідки транспортується до цитоплазми. Отже, білковий синтез, який відбувається в цитоплазмі, та транскрипція є окремими, розділеними у просторі й часі, етапами експресії гена. Інша принципова відмінність полягає в мозаїчності будови еукаріотичного гена (див. розділ 1): первинний транскрипт, що синтезується, не може бути використаним як матриця для білкового синтезу - принаймні тому, що в його складі є інтрони. Дозрівання пре-мРНК з утворенням функціональної матриці називають проце-сингом. Усі операції процесингу відбуваються під час транскрипції на РНК-полімеразному комплексі, тобто процесинг еукаріотичної мРНК є невід'ємною частиною транскрипції.
В еукаріотичних клітинах функціонують РНК-полімерази трьох типів: РНК-полімераза І працює на кластерах генів рибосомної РНК і синтезує рРНК 18S, 28S та 5,8S; РНК-полімераза ІІ транскрибує білкові гени, гени маленьких ядерних РНК і деяких інших РНК, котрі не піддаються трансляції; РНК-полімераза ІІІ здійснює синтез тРНК, рибо-сомної РНК 5S і кількох інших низькомолекулярних РНК. Кожна з цих полімераз містить від 12 до 16 субодиниць. Загальна архітектура еукаріотичних полімераз дуже схожа на таку прокаріотичної полімерази; спільними є й основні механізми роботи полімераз.
Кожна полімераза має свій набір базальних факторів транскрипції, які забезпечують точну посадку ферменту на промотор, вибір стартової точки (як і для прокаріотів, стартова точка транскрипції не збігається із стартовим кодоном для трансляції) та одного з ланцюгів ДНК як матричного. РНК-полімерази І та ІІІ є високоспеціалізованими - за допомогою своїх базальних факторів вони розпізнають 1-2 типи промоторів. РНК-полімераза ІІ працює на промоторах білкових генів, що відрізняються великим розмаїттям, і, крім базальних факторів, ініціація транскрипції РНК-полімеразою ІІ потребує специфічних факторів транскрипції, які розпізнають специфічні регуляторні елементи промоторів.
Промотор РНК-полімерази ІІ, узагальнену схему якого показано на рис. 2.11, може складатися з таких елементів послідовності (для конкретних промоторів спостерігаються численні варіації цієї схеми). Проксимальні (приблизно в зоні -50 ... -200 пар основ відносно старту транскрипції) і дистальні (будь-де відносно старту - на великій відстані, усередині кодуючої частини гена тощо) регуляторні елементи мають спорідненість до специфічних факторів транскрипції, взаємодія з якими активує / блокує зв'язування РНК-полімерази. Якщо дистальний елемент підсилює ефективність ініціації, його називають
енхансером (enhancer - підсилювач), якщо навпаки - сайленсером (silencer - глушник). У зоні старту міститься так званий базальний промотор, на якому, власне, і відбувається ініціація.
 |
|
Рис. 2.11. Приблизна узагальнена схема організації промотора РНК-полімерази ІІ та консенсусні послідовності основних елементів базального промотора |
Базальний промотор може включати (але не обов'язково) три елементи: ТАТА-бокс (починається приблизно з -30 пари основ), ініціато-рний елемент (Initiator, Inr) безпосередньо в зоні старту, DPE (Downstream Promoter Element) на відстані приблизно +30 пар основ від старту. Останні два елементи, Inr і DPE, як правило, присутні (якщо присутні) одночасно. Наприклад, близько 14 % промоторів дрозофіли містять усі три елементи, 29 % - тільки ТАТА-бокс, 26 % - тільки DPE разом з Inr, 31 % не мають жодного із трьох елементів. В останньому випадку промотор визначається іншими, більш специфічними елементами послідовності, що розпізнаються специфічними факторами, які, у свою чергу, взаємодіють із факторами базальними.
Для ініціації транскрипції є необхідним збирання на промоторі преініціаторного комплексу за участю РНК-полімерази ІІ й шести базальних (загальних) факторів транскрипції TFIIA, TFIIB, TFIID, TFIIE, TFIIF, TFIIH. Послідовність його збирання може бути різною, але всі базальні фактори мають бути присутніми у складі преініціаторного комплексу для подальшого запуску транскрипції. Фактор TFIID здійснює впізнання стандартних елементів базального промотора. TFIIB взаємодіє з TFIID і РНК-полімеразою, виконуючи функції, які дещо нагадують такі прокаріотичного фактора о (див. вище). TFIIH забезпечує
первинне плавлення подвійної спіралі при ініціації та здійснює фосфо-рилювання певних елементів РНК-полімерази, яке служить сигналом очищення промотора та початку елонгації. Інші базальні фактори додатково стабілізують комплекс і виконують допоміжну роль.
Ефективне збирання преініціаторного комплексу можливе лише за участі ще одного структурного модуля - медіатору, який містить понад 20 субодиниць. Цей мультибілковий комплекс здійснює лише білок-білкові взаємодії - із РНК-полімеразним комплексом та із специфічними факторами транскрипції, що зв'язані на проксимальних та дистальних елементах промотора (рис. 2.12). Отже, медіатор - це засіб передачі "активаційних сигналів" із регуляторних елементів послідовності на РНК-полімеразу: збільшення кількості взаємодій підсилює ефективність збирання преініціаторного комплексу.
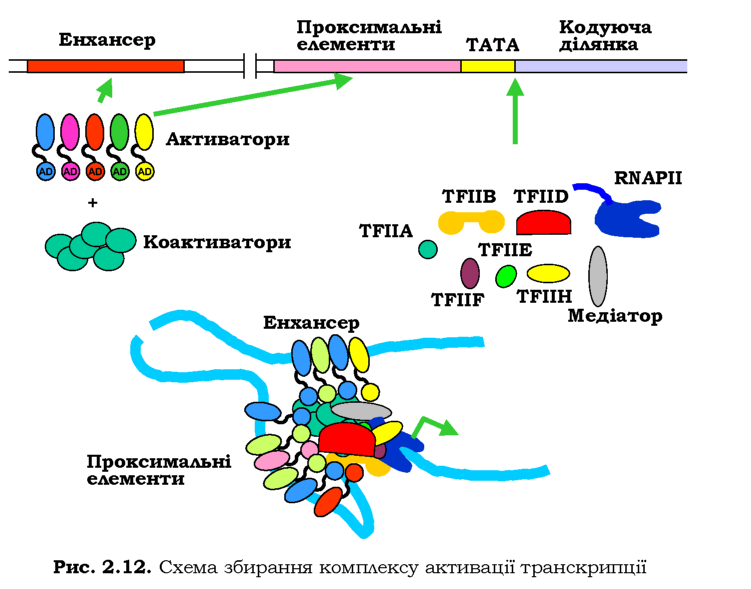
Більшість специфічних факторів транскрипції (далі позначатимуться як ТФ) мають у своїй структурі принаймні два домени: той, що взаємодіє з ДНК, і так званий активаційний (AD, Activation Domain), який використовується для взаємодії з іншими білками (рис. 2.12). Актива-
ційні домени зв'язують білкові кофактори (коактиватори), у результаті на дистальних і проксимальних елементах промотора формується складний мультибілковий комплекс - енхансосома. Активаційні домени ТФ і коактиватори мають спорідненість до медіатору та базальних факторів транскрипції. Результатом такої взаємодії є ефективне збирання преіні-ціаторного комплексу на базальному промоторі (рис. 2.12).
Після збирання преініціаторного комплексу відбувається локальне плавлення ДНК, матричний ланцюг занурюється в активний центр полімерази, де починається синтез короткого первинного транскрипту. Далі за рахунок активності TFIIH здійснюється фосфорилювання С-кінцевого домену (довгий невпорядкований поліпептидний хвіст) найбільшої із субодиниць РНК-полімерази, яке є точкою перемикання ініціації на елонгацію: відбувається очищення промотора, полімераза втрачає зв'язок із базальними факторами й продовжує синтез РНК.
Елонгація транскрипції, процесинг і термінація синтезу мРНК
Після синтезу перших 20-30 нуклеотидів до С-кінцевого домену РНК-полімерази (який узагалі служить платформою для збирання всієї машинерії процесингу) рекрутуються ферменти, які здійснюють певну хімічну модифікацію 5'-кінцевого нуклеотиду мРНК з утворенням кепу (cap). Функціональне значення кепу є багатоплановим: незвичайна будова 5'-кінця захищає його від нуклеазної деградації, він приймає участь у транспорті мРНК до цитоплазми та в ініціації трансляції, а також стимулює інші реакції процесингу.
Далі під час елонгації транскрипції, негайно після синтезу чергового інтрона, на С-кінцевому домені відбувається збирання мульти-молекулярної структури, яка називається сплайсосомою (рис. 2.13). Компонентами сплайсосоми є сам інтрон, білки та п'ять типів маленьких ядерних РНК. Призначення сплайсосоми полягає у здійсненні сплайсингу - вирізання інтронів і зшивання екзонів, у результаті чого мРНК стає копією лише кодуючої частини гена або її фрагментів: сплайсинг часто може здійснюватися кількома альтернативними шляхами (альтернативний сплайсинг, див. рис. 1.9).
Ключову роль у визначенні просторової структури, формуванні та функціонуванні сплайсосоми, яка утворюється окремо на кожному черговому інтроні, відіграють маленькі ядерні РНК: саме вони впізнають межі інтронів та екзонів, а також забезпечують каталіз реакцій сплайсингу (як і в рибосомі, каталіз у даному випадку здійснюється
молекулами РНК). Роль сплайсосомних білків зводиться до стабілізації структури сплайсосоми, сприяння перебудовам цієї структури під час здійснення операцій сплайсингу, а також регуляції сплайсингу - блокування чи підсилення ефективності збирання сплайсосоми на даному інтроні білками-регуляторами сплайсингу. Наявність певного набору таких регуляторів і визначає, головним чином, вибір того чи іншого шляху альтернативного сплайсингу.
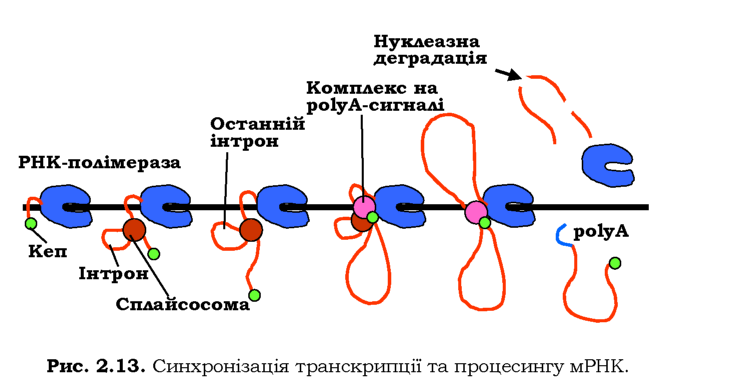
Швидкість збирання сплайсосом визначається швидкістю транскрипції. З іншого боку, зі сплайсосомою взаємодіють фактори елонгації транскрипції - наявність сплайс-сайта (межі між інтроном і ек-зоном) сприяє прискоренню руху полімерази. Такий процес синтезу РНК та її сплайсингу продовжується до моменту, поки в складі пре-мРНК не з'являється специфічна послідовність - сигнал термінації.
Останньою подією процесингу, тісно узгодженою з термінацією транскрипції, є поліаденілування З'-кінця мРНК - приєднання до З'-кінцевого нуклеотиду polyA-послідовності. Сигнал термінації транскрипції та поліаденілування polyA-сигнал) складається з двох елементів послідовності, які розпізнаються певним набором білкових факторів. Після впізнання polyA-сигналу, поки РНК-полімераза продовжує синтез РНК за сигналом (до 1 тис. нуклеотидів), до мультибілкового комплексу, який збирається на polyA-сигналі, долучаються polyA-полімераза та фактори розрізання мРНК. Збирання комплексу стимулюється зв'язаними з кепом білками, а також сплайсосомою на останньому інтроні -сплайсинг останнього інтрона й розрізання / поліаденілування РНК здійснюються одночасно та стимулюють одне одного (рис. 2.1З).
У межах другого елемента послідовності polyA-сигналу міститься консервативний динуклеотид, у якому відбувається розрізання. До З'-кінця, що виник унаслідок розрізу, polyA-полімераза приєднує один за одним 100-200 аденінових нуклеотидів. Розрізання / поліаденілу-вання РНК є тригером термінації транскрипції. Упізнання polyA-сигналу індукує конформаційні зміни в полімеразному комплексі, які приводять до зниження спорідненості полімерази до ДНК і транскрипту (рис. 2.1З).
Особливості білкового синтезу в еукаріотів
Узагальнену схему будови зрілої еукаріотичної мРНК, яка звільняється з полімеразного комплексу, транспортується в цитоплазму й використовується як матриця для білкового синтезу, зображено на рис. 2.14. Між кепом і початком кодуючої ділянки (стартовим кодоном) розташована 5'-кінцева зона, яка не транслюється (5' UTR -UnTranslated Region). За кодуючою ділянкою, яка закінчується одним із стоп-кодонів, і перед polyA-послідовністю міститься З'-кінцева зона, що не піддається трансляції. Обидві ці зони містять важливі елементи послідовності, які використовуються для регуляції білкового синтезу.

Кожна еукаріотична молекула мРНК має тільки одну рамку зчитування (один стартовий кодон), елементи системи ініціації трансляції в цитоплазмі взаємодіють спочатку з кепом на 5'-кінці молекули, після чого відбувається сканування матриці з метою пошуку стартового кодона (на відміну від прокаріотів, ініціація відбувається за так званим скануючим механізмом). Зовсім не обов'язково при цьому перший кодон AUG, що зустрічається, сприймається як стартовий. Упізнання стартового кодона залежить від контексту послідовності, в якій він розташований. Найкращим контекстом, який максимально сприяє ініціації трансляції, є послідовність Козак (Marilyn Kozak): GCC(A/G)CCAUGG. Відповідно, відхилення від цього контексту утруднює розпізнання стартової точки й зумовлює необхідність позитивної регуляції ініціації трансляції. Ефективність ініціації залежить також від: відстані стартового кодона від 5'-кінця мРНК - довге сканування матриці під час ініціації підвищує ймовірність руйнування комплексу; наявності / відсутності дволанцюгових шпильок у 5'-кінцевій зоні мРНК, що не транслюється, які гальмують процес сканування; присутності / відсутності регуляторних білків або молекул мікроРНК (див. нижче), які зв'язуються в 5'-кінцевій зоні.
Елонгація трансляції також є мішенню регуляторних впливів: наявність шпильок усередині кодуючої частини мРНК гальмує елонгацію, як і репресори, що впізнають елементи послідовності мРНК. Зміна часу життя мРНК - ще один шлях регуляції експресії гена. Час життя мРНК у цитоплазмі залежить головним чином від ступеня захищеності З'-кінця від екзонуклеаз (оскільки кеп є нечутливим до нуклеаз). Додатковий захист створюють білки, які зв'язуються у З'-кінцевій зоні - відсутність такого зв'язування приводить, відповідно, до швидкої деградації.
Регуляція генної експресії в еукаріотів
Регуляція транскрипції
Кілька десятків тисяч еукаріотичних генів потребують диферен-ційної активації / репресії в певні моменти залежно від типу клітин, стадії розвитку, зовнішніх умов тощо.
Транскрипційні фактори. Як і в прокаріотів, ключовими елементами системи регуляції транскрипції є регуляторні цис-елементи послідовності (проксимальні та дистальні елементи промоторів, див. рис. 2.11) і транс-регулятори - білкові транскрипційні фактори (ТФ, під якими будемо розуміти специфічні, не базальні, фактори транскрипції). Проте кількість еукаріотичних генів значно більша, і зрозуміло, що кожен ген не може контролюватися своїм особливим фактором транскрипції: фактор також є продуктом певного гена, який також має контролюватися певним фактором.
Відповіддю на необхідність регулювати окремо активність великої кількості генів лімітованим набором факторів транскрипції є принцип модульності будови еукаріотичних промоторів. Його ілюструє рис. 2.15: три регуляторні (наприклад, проксимальні) елементи послідовності мають спорідненість до трьох транскрипційних факторів, із трьох пар такої взаємодії можна скласти шість комбінацій. Насправді ж кількість таких пар є значно більшою, а число можливих комбінацій -практично нескінченно великим. Кожен промотор може мати свій власний набір модулів, який відрізняє його від інших промоторів, і, відповідно, власний набір досить великої кількості транскрипційних факторів, потрібних для активації гена.
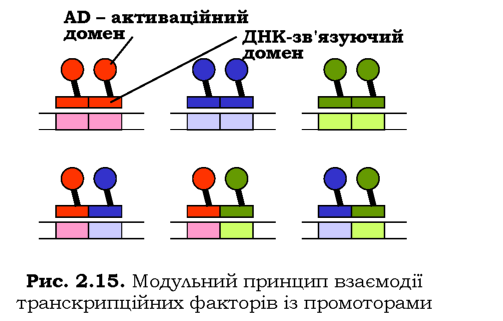
З принципом модульності тісно пов'язаний принцип кооператив-ності взаємодії транскрипційних факторів із цис-елементами, що знаходяться поряд. Кожен із ТФ зазвичай має порівняно невисоку спорідненість до відповідного елемента послідовності. Але якщо два цис-елементи розташовані поруч і два ТФ здатні взаємодіяти між собою, спорідненість кожного з них підвищується - стабільність комплексу значно зростає.
Крім того, активаційні домени ТФ зв'язують білкові кофактори (коактиватори), що зумовлює збирання енхансосоми та преініціатор-ного комплексу (див. рис. 2.12). Різні елементи енхансосоми діють синергічно, підвищуючи загальну стабільність комплексу. З іншого боку, відсутність кількох елементів може викликати дестабілізацію та розпад енхансосоми, де спорідненість до ДНК кожного окремого елементу невисока. Це забезпечує динамізм активації: енхансосома не є фіксованою, а збирається / розбирається в певні моменти. Слід зауважити, що компоненти мультибілкових комплексів, які збираються на промоторах, можуть, навпаки, блокувати ініціацію транскрипції -тоді їх називають репресорами та корепресорами.
Активність певного гена залежить від наявності у клітині певного набору активаторів / репресорів транскрипції. Відповідно, гени самих факторів транскрипції перебувають під контролем складних систем регуляції, які працюють під час розвитку та диференціації клітин. У результаті в клітині певного типу відбувається синтез специфічного набору ТФ, що приводить до активації специфічного набору генів.
У той же час, експресія певного гена може оперативно контролюватися у відповідь на зовнішні сигнали шляхом зміни активності вже синтезованих транскрипційних факторів. Два найважливіші механізми такої регуляції: взаємодія ТФ певного типу - гормонового рецептора -зі стероїдними гормонами та каскади пострансляційних модифікацій у відповідь на дію хімічних сигналів (сигнальна трансдукція). Гормо-новий рецептор у відсутності гормону перебуває в цитоплазмі в неактивному структурному стані. Коли гормон проникає в цитоплазму, він взаємодіє з рецептором, що зумовлює його активацію: гормоновий рецептор прямує до ядра, де зв'язується зі специфічним елементом послідовності та запускає каскад збирання енхансосоми. Прикладом сигнальної трансдукції є зв'язування білкового гормону з рецептором на зовнішньому боці клітинної мембрани, яке активує примембранну кіназу з іншого боку мембрани. Кіназа здійснює фосфорилювання неактивного транскрипційного фактора, що й переводить його в активну форму. Часто примембранна кіназа запускає каскад фосфорилювання - фосфорилює білок, який набуває внаслідок цього кіназної активності, ця нова кіназа фосфорилює інший білок (або кілька різних білків, завдяки чому здійснюється підсилення сигналу та / або його розгалуження по кількох шляхах, спрямованих до кількох кінцевих мішеней), перетворюючи його на кіназу, і так далі - до фосфорилювання та, відповідно, активації транскрипційного фактора.
Регуляція транскрипції та структура хроматину. Суттєвою особливістю еукаріотів є та обставина, що ДНК клітинного ядра організована у складні хроматинові структури (розділ 1). Нуклеосоми та хро-матинова фібрила в цілому виступають як загальний репресор генної активності. Тим самим вони допомагають забезпечити загальну інактивацію більшості генів в еукаріотичній клітині, за винятком тих, чия активація здійснюється за участю ТФ. Активація транскрипції потребує перебудов структури хроматину в напрямку деконденсації хрома-тинової фібрили та визволення цис-елементів від нуклеосом. Для реалізації таких перебудов є два основні інструменти, які діють у тісній координації один з одним: система посттрансляційних модифікацій гістонів і АТР-залежні комплекси рем.оделювання хроматину, що проводять репозиціювання нуклеосом. Специфічна картина (патерн) гісто-нових модифікацій відіграє також і зворотну роль - у здійсненні гарантованої репресії певних ділянок хроматину.
Серед інших модифікацій, ацетилювання залишків Lys (у певних консервативних позиціях) майже завжди корелює з активацією транскрипції - ацетильовані гістон-ацетилтрансферазами (НАТ) гістони акумулюються в активних промоторах, і навпаки, дія гістон-деацетилаз приводить до інактивації. Ацетилтрансферази та деацетилази постійно безадресно працюють у хроматині, підтримуючи певний базовий баланс ацетилювання / деацетилювання гістонів. При активації певного промотора ацетилтрансферази здійснюють адресне гіперацетилюван-ня, а після зникнення активуючого сигналу деацетилази повертають промотор до базового неактивного стану. Деацетилази також можуть бути адресно рекрутовані до промоторів репресорами транскрипції для підтримання гарантованого деацетильованого статусу.
НАТ входять до складу мультибілкових комплексів, які часто є компонентами енхансосом. Часто у складі НАТ присутні бромодомени -структурні модулі, що мають специфічну спорідненість до ацетильова-них лізинів. Тобто НАТ упізнають Lys, уже ацетильовані іншими НАТ, і здійснюють ацетилювання сусідніх нуклеосом, підтримуючи таким чином ацетильований статус певної ділянки хроматину. Ацетилювання гістонів сприяє деконденсації хроматинової фібрили за рахунок зниження позитивного заряду головних факторів конденсації, якими є гістонові хвости. Розгортання фібрили та тимчасова дисоціація гістона Н1 створює "вікно можливості" для зв'язування регуляторних факторів із міжнуклеосомною лінкерною ДНК. Крім того, ацетильовані лі-зинові залишки гістонів можуть безпосередньо впізнаватися факторами і кофакторами транскрипції. Наприклад, наявність бромодомену у складі TFIID сприяє підвищенню локальної концентрації цього базального фактора транскрипції в ацетильованих ділянках хроматину.
Підвищення доступності промоторів під час їхньої активації потребує також інших спеціальних механізмів. Справа в тому, що за фізіологічної іонної сили електростатичні взаємодії ДНК і гістонів дуже міцні й нуклеосома зберігає високу стабільність, яка практично виключає навіть переміщення нуклеосоми вздовж ДНК. Оскільки переміщення нуклеосом є необхідним для експонування регуляторних сайтів на ДНК до дії транскрипційних факторів, у клітині існує спеціальна система: комплекси ремоделювання хроматину (КР), які часто є компонентами енхансосом. КР є АТР-залежними мультибілковими молекулярними машинами, які забезпечують переміщення нуклеосом уздовж хроматинової фібрили (репозиціювання) і сприяють тимчасовому видаленню нуклеосом із активних промоторів на білки, що є проміжними переносниками гістонів. КР здатні здійснювати численні взаємодії з нуклеосомною ДНК, гістоновими хвостами, специфічними та загальними факторами транскрипції, гістон-ацетилтрансферазами тощо. Слід зауважити, що дія комплексів ремоделювання приводить не обов'язково до активації транскрипції, а також і до репресії - залежно від контексту інших функціонально важливих впливів, у кооперації з якими працює даний комплекс.
Один із численних варіантів сценаріїв активації промотора зображено на рис. 2.16: одна з нуклеосом закриває базальний промотор; у лін-кері між нуклеосомами ініціюється збирання енхансосоми, до складу якої залучається НАТ; НАТ здійснює ацетилювання гістонів; до енхансосоми рекрутується інша НАТ і комплекс ремоделювання, який переміщує нуклеосому; із базальним промотором зв'язується РНК-поліме-раза та базальні фактори транскрипції.
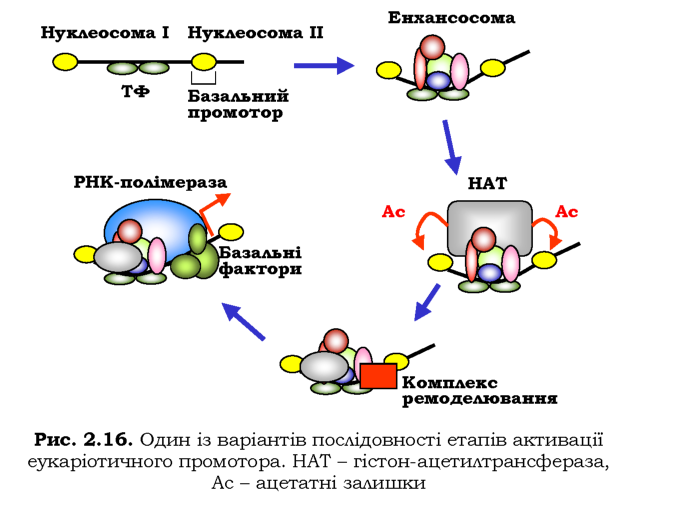
На стадії елонгації транскрипції нуклеосома також має створювати суттєві перешкоди для проходження РНК-полімерази. При цьому хроматин, навіть у межах активних генів, у цілому зберігає нуклеосомну структуру. Елонгація РНК-полімерази через хроматин полегшується цілим набором факторів елонгації, які, зокрема, забезпечують руйнуванням нуклеосом попереду полімерази та їхнім відновленням позаду.
Хоча базова структура інтерфазного хроматину - фібрила діаметром 30 нм - є перешкодою для активації транскрипції, гарантована репресія потребує підвищення ступеня компактизації хроматину. Така додаткова компактизація в гетерохроматині та інших репресованих ділянках залежить від спеціальних хімічних маркерів. Найважливішими з них є знову ж таки посттрансляційні модифікації гістонів (у першу чергу метилювання специфічних залишків Lys) і метил-ювання ДНК. Механізми такої репресії розглядаються в розділі 6.
РНК-інтерференція
РНК-інтерференція є ще однією системою негативної регуляції експресії генів через використання мікро-РНК. Активація генів мікро-РНК (транскрибуються РНК-полімеразою ІІ) зумовлює синтез молекул РНК, які містять дволанцюгові шпильки. Шпильки вирізаються нук-леазою і стають субстратом для РНКази, яка отримала назву дайсер (Dicer). Останній деградує будь-яку дволанцюгову РНК до фрагментів довжиною 19-21 пара основ. Ці фрагменти зв'язуються з кількома білками, утворюючи комплекс RISC (RNA Induced Silencing Complex). Один із ланцюгів дволанцюгової РНК є комплементарним до ділянки мРНК певного білкового гена, яка й стає мішенню для комплексу. Результатом взаємодії з мРНК може бути: рекрутування білками комплексу ферментів, які здійснюють метилювання гістонів, що приводить до компактизації хроматину та репресії гена; посттранскрипційна деградація мРНК за рахунок нуклеазної активності комплексу (характерніше для рослин); зупинка білкового синтезу (більш характерно для тварин - у цьому випадку взаємодія з мРНК відбувається в цитоплазмі).
Альтернативний сплайсинг
Пре-мРНК, що синтезується під час транскрипції, може піддаватися сплайсингу та поліаденілуванню різними альтернативними шляхами (рис. 2.17): кілька екзонів на початку чи всередині гена можуть вирізатися з транскрипту, останній може обрізатися та піддаватися поліадені-луванню за рахунок використання polyA-сигналу всередині одного з інт-ронів тощо. У результаті утворюються різні молекули мРНК з різними наборами екзонів які, відповідно, кодують різні білки. Середня кількість альтернативних форм мРНК оцінюється у 5,4 на один ген людини.
Багатокомпонентність (і необхідність кооперації між компонентами) сплайсосоми та системи розрізання / поліаденілування дозволяє здійснювати тонку регуляцію утворення мРНК певного типу за рахунок зміни транскрипційної активності генів, які кодують ті чи інші компоненти машинерії процесингу, зміни концентрацій компонентів, їхньої хімічної модифікації.
Ключова роль у визначенні шляху сплайсингу належить білкам-регуляторам сплайсингу. Наприклад, досить часто регулятор специфічно зв'язується з певною послідовністю нуклеотидів усередині ек-зона та стимулює розпізнання меж з інтронами (сплайс-сайтів) по обидва боки від нього. Зрозуміло, що в разі відсутності регулятора такий екзон буде вирізано разом з інтронами, що його фланкують. Регулятор, навпаки, може блокувати впізнання сплайс-сайтів. Сплайсинг-регулятори можуть мати сайти зв'язування в інтронах, впливаючи на ефективність збирання сплайсосоми. Вибір шляху утворення кінцевого мРНК-продукту часто залежить також від альтернативного вибору за допомогою сплайсинг-регуляторів polyA-сигналів, які можуть бути присутніми не лише нижче останнього екзона, а й усередині інтронів.
 |
|
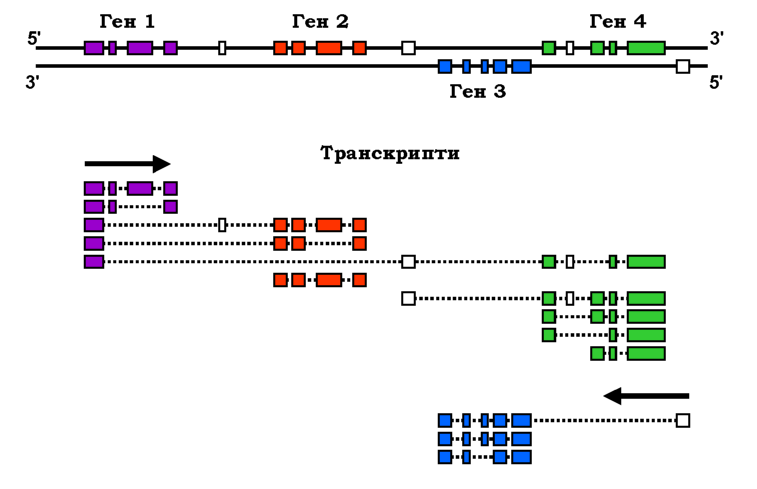
Рис. 2.17. Зона еукаріотичного геному: показано чотири гени та відповідні екзони (прямокутники) у складі змістовних ланцюгів. Прямокутники білого кольору важко віднести до конкретного гена. Унизу: кінцеві транскрипти, синтезовані у цій зоні, стрілки вказують напрям транскрипції |
Поряд із спласинг-регуляторами, досить важливим фактором регуляції сплайсингу є швидкість транскрипції: чим нижча швидкість, тим більше часу "розібратися" із сигналами - на великій швидкості полімераза може "проскочити" через екзон чи polyA-сигнал. При цьому швидкість (частота рекрутування полімераз до промотора) визначається на стадії ініціації транскрипції та контролюється транскрипційними факторами. Отже, значною мірою шлях сплайсингу визначається вже на етапі ініціації. При цьому до промотора (а отже, і до РНК-полімеразного комплексу) можуть рекрутуватися також і регулятори сплайсингу.
Для еукаріотичних генів досить часто спостерігається також явище транс-сплайсингу: об'єднання у складі мРНК екзонів різних генів. Основою для транс-сплайсингу є та обставина, що для багатьох генів існує не одна, а кілька альтернативних стартових точок транскрипції, у тому числі й такі, що розташовані досить далеко від гена й водночас є стартовими точками інших генів (рис. 2.17). У результаті транскрипція іноді здійснюється через кілька генів (така ситуація дещо нагадує розглянуті вище прокаріотичні оперони) і сплайсинг відбувається на рівні таких "об'єднаних" первинних транскриптів.
Крім того, описано також випадки транс-сплайсингу між пре-мРНК, які є продуктами різних одиниць транскрипції, іноді такими, що розташовані на різних хромосомах. У цьому випадку на 5'- і З'-кінцях двох пре-мРНК міститься ніби "розірваний" інтрон - об'єднання двох кінців у сплайсосомі приводить до видалення цього інтрона та зшивання кінцевих екзонів.
Що таке ген?
Термін "ген" було запропоновано Йоханнсеном (Wilhelm Johannsen) у 1909 р., невдовзі після відкриття заново менделівських законів спадковості (див. історичну довідку наприкінці підручника). Із тих часів поняття гена кілька разів піддавалося суттєвій ревізії. Частину різних відповідних його визначень було наведено в розділі 1, і слід зауважити, що всі вони мають право на існування. Але важливо розуміти, що кожне з них має в той самий час досить суттєві обмеження. Беззаперечним є лише те, що ген є ділянкою ДНК (і навіть це твердження потребує уточнень стосовно вірусів, що містять РНК як генетичний матеріал, див. розділ 5), проте таке визначення нічого не говорить про властивості, які мають бути притаманні цій ділянці, щоб її можна було вважати геном.
Від початку існування термін інтерпретувався в дусі Менделя, тобто як дискретна й нероздільна спадкова одиниця, яка не залежить від інших спадкових одиниць і відповідає за прояв певної ознаки. В окремих випадках (згаданий у розділі 1 ген sgr гороху є прикладом такого типу) така інтерпретація може бути застосована, хоча зрозуміло, що про незалежність спадкування різних генів можна говорити тільки за умови, що гени містяться в різних хромосомах.
Зрозуміло також, що ген не є дискретним і нероздільним: ген як ділянка ДНК має довжину, ця ділянка може бути розділеною на фрагменти. У процесі своєї експресії гени взаємодіють на різних рівнях: активація транскрипції та шлях сплайсингу залежать від активності генів транскрипційних факторів і сплайсинг-регуляторів, трансляція мРНК - від активності генів білків-регуляторів трансляції; білкові продукти різних генів взаємодіють тощо. У результаті активність одного гена може підсилити чи пригнітити експресію іншого, і взагалі, для прояву ознаки, як правило, є необхідною активність кількох генів. Останнім часом набула популярності комп'ютерна метафора, згідно з якою спадковий апарат (геном і систему його експресії) можна розглядати як "операційну систему", що керує організмом, а ген - як "підпрограму" цієї системи.
Після того, як було з'ясовано, що гени знаходяться в хромосомах, ген став розглядатися як хромосомний локус, а сама хромосома -як лінійна комбінація генів, що не перекриваються. Часто так воно і є, але, з іншого боку, один локус (одна ділянка хромосомної ДНК) може містити кілька генів - гени перекриваються або за рахунок перекриття рамок зчитування (деякі бактеріофаги та окремі гени еукаріотів), або за рахунок розташування генів (в еукаріотичних геномах) у межах інтрону іншого гена, або за рахунок розташування двох кодуючих послідовностей на одній ділянці ДНК на двох різних ланцюгах (як на рис. 2.17). Крім того, концепція гена як локусу не може бути застосована для мобільних елементів - ділянок ДНК (які часто містять один або кілька генів), що можуть змінювати свою локалізацію в геномі.
Розвиток молекулярної біології спочатку привів до розуміння того, що ген - це ділянка молекули ДНК, яка відповідає за синтез молекули білка ("один ген - один білок"). Іноді це справді так, проте сьогодні вже ясно, що, по-перше, не менш важливими є гени, що кодують різноманітні РНК, які не піддаються трансляції. По-друге, одна ділянка ДНК (сукупність екзонів еукаріотичного гена) часто дає кілька білкових продуктів за рахунок альтернативного сплайсингу. Різниця між біологічними видами часто зумовлена не тільки і не стільки різницею в наборах кодуючих послідовностей (екзонів), скільки різними комбінаціями цих екзонів. Причому таке перекомбінування можливо як на рівні ДНК, так і на рівні кінцевих транскриптів. Отже, якщо трактувати ген як спадковий фактор, то ген - це не тільки ділянка ДНК, що містить певну інформацію, а й система експресії цієї інформації.
Інтенсивний розвиток протягом останніх 10-15 років нової дисципліни - геноміки, що спрямована на встановлення та аналіз нуклеотид-них послідовностей цілих геномів, зумовив тенденцію розглядати ген як анотовану геномну ділянку з певними властивостями. Згідно з визначенням міжнародного консорціуму онтології послідовностей (Sequence Ontology Consortium), ген - це певна визначена зона геномної послідовності, яка відповідає одиниці спадковості й містить регуляторні ділянки та ділянки, що транскрибуються. Під словами "одиниця спадковості" слід розуміти той факт, що ген кодує певні (один або кілька) функціональні продукти (білки або молекули РНК, що не транслюються). Під "ділянкою, що транскрибується" мається на увазі певна група екзонів, з'єднаних інтронами, яка транскрибується як одне ціле. При цьому за правилами анотації послідовностей, прийнятими сучасними базами даних геномних послідовностей, первинні транскрипти, котрі піддаються альтернативному сплайсингу, вважаються такими, що належать одному гену, навіть якщо кінцеві білки є різними. Тобто ген - це група екзонів, що транскрибуються разом, або ген - це ділянка геному, що дає набір кінцевих транскриптів, які містять хоча б один спільний екзон. Нарешті, важливим моментом наведеного визначення гена є те, що до складу цієї елементарної одиниці спадковості організму прийнято включати регуляторні ділянки, які контролюють його активність.
З тим уточненням, що в прокаріотичних системах (у випадку оперо-нів) регуляторні ділянки можуть контролювати групу генів, таке трактування гена до самого останнього часу залишалося загальноприйнятим.
З метою ретельного аналізу інформації, яка записана в геномі й реалізується внаслідок транскрипції, чотири роки тому Національним інститутом США з вивчення геному людини (National Human Genome Research Institute) було започатковано міжнародний проект ENCODE (Encyclopedia of DNA Elements), одним з основних завдань якого є тотальний аналіз транскриптому людини. Нещодавно було завершено перший етап цієї роботи - проаналізовано функціонування 1 % геному людини (приблизно 30 млн пар основ), і перші результати принесли низку несподіванок (The ENCODE Project Consortium / / Nature, 2007, Vol. 447, P. 799-816).
По-перше, відносна кількість ДНК, що піддається транскрипції, виявилася неочікувано високою - на рівні 80 %. Зважаючи на частку геному, яку становлять екзони разом з інтронами (див. рис. 1.10), виникає питання, чи всі ці транскрипти відповідають генам? Напевно, частина цих первинних транскриптів є просто наслідком неспецифічної хаотичної активності РНК-полімераз. Проте значна частка транскриптів містить консервативні (для ссавців і серед популяцій людини) елементи послідовності - близько 60 % таких елементів знаходиться поза межами відомих раніше білкових генів чи регуляторних ділянок. Імовірно, у багатьох випадках ці транскрипти є невідомими раніше РНК, які не піддаються трансляції, для більшості з них їхнє функціональне значення ще має бути з'ясовано. Крім того, було встановлено, що часто піддаються транскрипції регуляторні ділянки (промотори, енхансери). Імовірно, така транскрипція є просто одним із способів підтримувати регуляторну ділянку в доступному стані де-конденсованої хроматинової фібрили.
Для відомих білкових генів (399 у дослідженій частині геному) було продемонстровано наявність великої кількості невідомих раніше стартових точок транскрипції. Приблизно половина генів мають альтернативні стартові точки, які відстоять на 100 тис. пар основ від анотованих раніше стартів транскрипції цих генів. Деякі з цих стартових точок використовують промотори інших генів: одна така точка може бути спільною для двох чи трьох генів, і первинний транскрипт іноді місить кілька генних локусів - груп екзонів (див. рис. 2.17).
Крім того, для більшості білкових генів аналіз їхніх транскриптів показує наявність невідомих раніше екзонів. Деякі з цих екзонів розташовані на відстані до кількох тисяч пар основ від усіх інших екзонів гена, іноді опиняючись у межах іншого гена. Як демонструє рис. 2.17, іноді важко віднести даний екзон до того чи іншого конкретного гена. Більшою за очікувану виявилася кількість різних ізоформ мРНК, що виникають як унаслідок альтернативного сплайсингу, так і транссплайсингу.
Результати проекту ENCODE вказують на диспергований характер розподілу регуляторних елементів по всьому геному: багато регуляторних елементів розташовано всередині екзонів та інтронів, при цьому вони можуть бути елементами системи регуляції зовсім іншого гена.
Отже, поняття гена знову потребує певної ревізії. Відповідно до одного з нещодавно запропонованих визначень, ген - це об'єднання (union) геномних послідовностей, що кодують зв'язний (coherent) набір функціональних продуктів, які можуть частково перекриватися (Gerstein et al. // Genome Res., 2007, Vol. 17, Р. 669-681). Під когерентністю набору продуктів мається на увазі, що у випадку білкових генів кожен екзон є спільним хоча б для двох продуктів даного набору.
Головний акцент у цьому визначенні робиться на кінцеві продукти активності генів - перекриття між проміжними транскриптами ігнорується. Якщо виходити з перекриття між первинними транскриптами (інтерпретувати ген як кластер екзонів, що можуть спільно транскрибуватися), то, наприклад, на геномній ділянці рис. 2.17 слід було б визначити лише два гени (об'єднавши гени 1, 2, 4 в один). Якщо ж виходити з перекриття між кінцевими продуктами, то на цій ділянці міститься принаймні шість генів (гени 1-2 та 1-4 формують окремі групи екзонів, що частково перекриваються з генами 1, 2, 4). Тобто ген не обов'язково складається з екзонів, що розташовані поряд; група екзонів одного гена може бути диспергованою по геномній зоні, і окремі екзони групи можуть одночасно належати до інших генів.
Зрозуміло, що у простому випадку, коли немає альтернативного сплайсингу (або взагалі немає інтронів), визначення зводиться до класичного: ген - це ділянка ДНК, що кодує молекулу білка або РНК.
Крім того, згідно з визначенням, що обговорюється, регуляторні елементи не є компонентами гена (пропонується називати їх "елементами, асоційованими з генами" - gene-associated): система регуляції є складнішою, ніж просте співвідношення "один до одного" між регуляторними елементами та кодуючими ділянками.
Наведене визначення, звичайно, не може вважатися остаточним. Очевидно, що поняття гена є надто складним, щоб його можна було чітко сформулювати: різні визначення, які акцентують увагу на різних властивостях генів різних типів, є, відповідно до принципу дода-тковості, одночасно справедливими.
Контрольні запитання і завдання
1. Що таке кодон і відкрита рамка зчитування? Скільки існує кодонів? Які позиції нуклеотидів у складі кодона є найбільш і найменш визначальними?
2. Охарактеризуйте етапи білкового синтезу. Яку роль у синтезі білків виконує рибосома та тРНК?
3. У чому полягають характерні відмінності механізмів експресії генетичної інформації у про- та еукаріотів?
4. В якому напрямку здійснюється зчитування інформації з ДНК під час транскрипції? Що таке змістовний і антизмістовний ланцюги? Який із них є матричним?
5. Яка різниця між цис- і транс-елементами системи регуляції транскрипції?
6. Опишіть систему регуляції лактозного оперона.
7. Яку будову мають бактеріальний промотор і промотор еукаріотичної РНК-полімерази ІІ?
8. Яку спеціалізацію мають еукаріотичні РНК-полімерази різних типів?
9. Сформулюйте основні принципи регуляції транскрипції за участю транскрипційних факторів.
10. Як узгоджуються транскрипція та процесинг мРНК в еукаріотів?
11. Опишіть основні механізми активації транскрипції в еукаріотів.
12. Що таке РНК-інтерференція?
13. Як відбувається вибір альтернативних шляхів сплайсингу?
14. Дайте визначення транс-сплайсингу. За якими механізмами він здійснюється?
15. Сформулюйте кілька визначень гена. Поясніть обмеження, які має кожне з них.
Автор: admin от 18-07-2013, 14:32, Переглядів: 18719