Способи добування кислот
Мешканці Лондона донедавна опалювали свої помешкання вугіллям. Через що у повітря потрапляли вуглекислий та сірчистий гази, а також тонкодисперсні частинки вугілля. Водяна пара, що конденсувалася на частинках пилу, сполучалася із газами і утворювала кислоти, що складали кислотний туман — лондонський смог. Проте це вже історія. Повітря у Лондоні зараз чисте й прозоре, бо каміни можна використовувати тільки електричні. А от кислоти продовжують добувати за реакцією розчинення кислотних оксидів у воді.
Розглянемо загальні способи добування кислот, які можуть бути застосовані як у промисловості, так і в лабораторії.
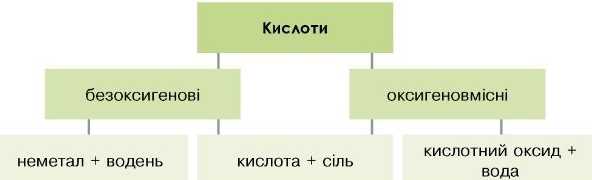
Оскільки кислоти класифікують як оксигеновмісні та безоксигенові, існують спільні та відмінні способи їхнього добування.
Добування безоксигенових кислот
1. Взаємодія деяких неметалів з воднем.
Внаслідок цієї реакції утворюються леткі сполуки з Гідрогеном, які, розчиняючись у воді, утворюють відповідні кислоти.
H2+ Cl, = 2HC1T водень хлор гідроген хлорид
Гідрогенхлорид добре розчиняється у воді, утворюючи хлорид ну кислоту.
Пригадайте! Як довести, що під час розчинення у воді гідроген хлориду утворюється хлоридна кислота?
У 1772 році Дж. Прістлі за реакцією кухонної солі з концентрованою сульфатною кислотою добув газ — гідроген хлорид. Розчин цього газу у воді він назвав «мурієва кислота».
2. Взаємодія кислоти із сіллю, що містить простий кислотний залишок.
Більшість таких реакцій відбувається під час взаємодії твердої солі та концентрованого розчину кислоти. Добутий газ розчиняється у воді з утворенням кислоти.
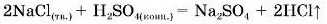
Добування оксигеновмісних кислот
1. Взаємодія деяких кислотних оксидів з водою.
SO3 I H2O = H2SO1
Напишіть рівняння реакції взаємодії фосфор(У) оксиду з водою. Назвіть продукт реакції.
Пам’ятайте!
• Кислотний оксид SiO2 не взаємодіє з водою.
• Силікатну кислоту можна добути реакцією обміну між розчином відповідної солі та сильної кислоти.
2. Взаємодія солей з кислотами.
Реакція обміну відбувається лише за умови, якщо один з продуктів реакції — осад або газ.
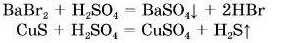
ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
Напишіть рівняная реакції взаємодії натрій силікату з хлорадною кислотою. Вкажіть, який із продуктів реакції — осад.
|
2KNOaiB,+ H2SO41kohiij= K2SO1 + 21INO4I |
Рефлексу- мо. Попрацюйте в групах. Проаналізуйте схему та доповніть Ті відповідними реакціями.
Якщо необхідно добути сильну та летку оксигено-вмісну кислоту, для реакції обміну необхідно брати тверду сіль і нелетку концентровану сульфатну кислоту.
Способи добування кислот
Запитання та завдання
1. Назвіть спільні та відмінні способи добування оксигеновмісних і без-оксигенових кислот.
2. Чим силікатна кислота відрізняється від інших кислот?
3. Назвіть явища, що супроводжують реакції добування оксигеновмісних кислот.
У завданнях 4-6 вкажіть одну правильну відповідь.
4. Вкажіть кислотний оксид, під час взаємодії якого з водою не утворюється кислота.
А сульфур(ІУ) оксид В нітроген(І\/) оксид
Б силіцій(І\/) оксид Г сульфур(УІ) оксид
5. Вкажіть формулу солі, з якої можна добути гідроген сульфід.
A BaSO3 Б BaSO4 В BaS
6. Вкажіть пару речовин, під час взаємодії яких утворюється нітратна кислота.
A N2O5TaKOH Б N2O3TaH2O В N2O3TaKOH Г N2O5TaH2O
Виберіть дві правильні відповіді.
7. Встановіть речовини х та у в схемі перетворень:
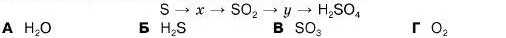
8. Обчисліть, якій кількості речовини відповідає 48,16· 1023 атомів у гідроген хлориді.
9. Здійсніть перетворення та напишіть відповідні рівняння, що лежать в основі схеми:
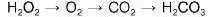
10. Обчисліть кількість речовини нітратної кислоти та об єм води, що необхідні для отримання розчину нітратної кислоти масою 400 г з масовою часткою кислоти 12,6 %.
11. Обчисліть масу силікатної кислоти, що утворюється під час взаємодії натрій силікату з хлоридною кислотою масою 146 г.
12. Відновіть схеми хімічних реакцій і перетворіть їх на рівняння.
SO2 +? -» H2SO3 Na2S +? -> NaCI +?
? + HCI -* MgCI2 + SO2I +? H2 +? -> 2HF
Ba(NO3)2 +? -» BaSO4 +?
13. Складіть рівняння реакцій добування ортофосфатної кислоти різними способами.
14. «Ляпіс» — речовина, відома людству ще з часів алхіміків, які називали її «пекельним камінням». У сучасній медицині «ляпіс» застосовують
для видалення бородавок, припікання ран. До його складу входить арґентум нітрат. Обчисліть масу кислоти, яка утвориться з арґентум нітрату масою 212,5 г.
Знайдіть в інтернеті історію відкриття та значення назви «мурієва кислота».
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 22:27, Переглядів: 3242