Хімічні властивості солей
«Назвою солей позначають крихкі тіла, що розчиняються у воді, причому вона залишається прозорою; вони не загоряються, якщо в чистому вигляді піддаються дії вогню...»
М. Ломоносов
Ви вже вивчили хімічні властивості трьох основних класів неорганічних сполук: оксидів, основ та кислот. Часто реагентами або продуктами реакцій були солі. Отже, серед властивостей солей є такі, що вже відомі вам з попередніх параграфів: реакції лугів та розчинів кислот із солями та їхніми розчинами.
Пригадайте! Які сполуки називають солями? Яка загальна формула солей?
1. Солі реагують з розчинами кислот з утворенням нової солі та нової кислоти.
Реакція обміну відбувається, якщо кислота, що вступає в реакцію, сильніша за кислоту, що утворюється.
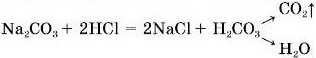
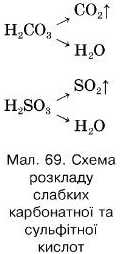
Продукт реакції — слабка карбонатна кислота — нестійка, під час утворення розпадається на вуглекислий газ і воду. Аналогічно розкладається сульфітна кислота (мал. 69).
Обов’язковою умовою перебігу реакцій солей з кислотами є утворення осаді) або виділення газу:
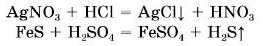
2. Солі реагують з лугами з утворенням нової солі та пової основи.
Реакція обміну відбувається лише між розчинними у воді солями та розчинами лугів за умови, якщо один із продуктів реакції нерозчинний у воді (осад):
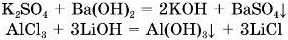
Лабораторний дослід № 6
Взаємодія солей з лугами у водному розчині
Пригадайте правила безпеки під час проведення лабораторних дослідів (див. додаток 2).
1. Проведіть досліди.
В одну пробірку налийте 1-2 мл розчину купрум(ІІ) сульфату, в іншу 1-2 мл розчину натрій карбонату. Обережно додайте в пробірку з розчином купрум(ІІ) сульфату розчин натрій гідроксиду, у пробірку з розчином натрій карбонату — розчин кальцій гідроксиду. Що спостерігаєте?
2. Запишіть рівняння проведених реакцій.
3. У висновку зазначте, який продукт реакції випав в осад та до якого класу неорганічних сполук він належить.
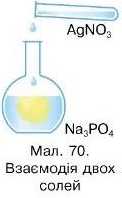
3. Солі реагують з іншими солями з утворенням двох нових солей (мал. 70).
Реакція обміну відбувається лише між розчинними у воді солями за умови, якщо утворюється нерозчинний продукт реакції (осад):
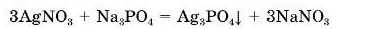
Лабораторний дослід № 7
Реакція обміну між солями у водному розчині
Пригадайте правила безпеки під час проведення лабораторних дослідів {див. додаток 2).
1. Проведіть дослід.
У пробірку налийте 1-2 мл розчину натрій сульфату та обережно додайте розчин солі Барію. Що спостерігаєте?
2. Запишіть рівняння проведених реакцій.
3. У висновку зазначте, який продукт реакції випав в осад.
Солі можуть реагувати не тільки зі складними речовинами (лугами, кислотами, солями), але також із простими.
4. Солі реагують з металами, з утворенням нової солі та нового металу.
Реакція заміщення відбувається між розчинними у воді солями та металом, якщо метал, що вступає в реакцію, активніший за метал, що утворюється. Тобто, метал-реагент має бути розташований в ряду активності металів лівіше за метал — продукт реакції.
Алхіміки асоціювали свинець із планетою Сатурн.
Pb(NO;{)2 + Zn = Zn(NO3)2 + Pbj Якщо в розчин плюмбум(ІІ) нітрату занурити кумедно вигнутий цинковий дротик, то одразу можна побачити появу на дротику «голочок», а через годину — у склянці з розчином спостерігати «сатурно-ве дерево» (мал. 71). Це пояснюється тим, що цинк активніший за свинець і витісняє його з розчину плюмбум(Н) нітрату.
Лабораторний дослід № 8
Взаємодія металів із солями у водному розчині
Пригадайте правила безпеки під час проведення лабораторних дослідів {див. додаток 2).
1. Проведіть досліди.
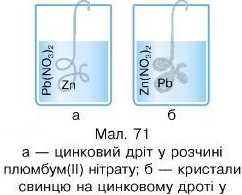
В один хімічний стакан обережно налийте розчин купрум(ІІ) сульфату, в інший розчин нікель(ІІ) сульфату. У хімічний стакан з
розчином купрум(ІІ) сульфату обережно покладіть залізний цвях, у хімічний стакан з розчином нікель(ІІ) сульфату — мідну пластинку або мідний дріт. Що спостерігаєте?
2. Запишіть рівняння проведених реакцій.
3. У висновку зазначте, у якому хімічному стакані відбулася реакція. Поясніть чому, носилаючися на ряд активності металів.
5. Термічний розклад солей.
Деякі малорозчинні або нерозчинні у воді оксиге-новмісні солі (карбонати або сульфіти) за нагрівання розкладаються на два оксиди:
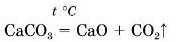
Пам’ятайте!
• Карбонати та сульфіти Натрію та Калію не розкладаються
під час нагрівання.
• Не розкладаються під час нагрівання силікати та фосфати.
• Розкладаються під час нагрівання нітрати всіх металів. (З
цими реакціями ви ознайомитеся у старших класах.)
Використання солей
Соду застосовують з давніх часів, наприклад, у Стародавньому Єгипті як миючий засіб. Природну соду добували з озерних вод. її використовували під час варіння скла.
До середини XVIII століття карбонати Натрію і Калію називали alkali (з араб. — луг), вважали, що вони мають властивості лугів.
Французький вчений Анрі Луї ДюамельДю Монсо у 1736 році розрізнив ці два класи сполук. З того часу натрій карбонат називають содою, калій карбонат — поташем.
Натрій хлорид NaCl кухонну сіль, використовують у харчовій промисловості та кулінарії. 0,9 %-ий розчин натрій хлориду в дистильованій воді фізіологічний розчин (мал. 72, с. 154), застосовують у медицині як дезінтоксикаційний засіб, який допомагає організму виоратися зі шкідливими речовинами. Взимку натрій хлорид, змішаний з іншими солями, піском (так звана «технічна сіль»), застосовують як засіб проти ожеледиці, яким посипають тротуари, дороги.
Натрій карбонат Na2COa — кальциновану соду, використовують при виробництві скла, мила та пральних порошків, порошків для чищення поверхонь. Також його застосовують для пом’якшення води.

Натрій нітрат NaNO3 застосовують як мінеральне добриво, як складову вибухових речовин. Він також входить до складу ракетного палива. Піротехнічні суміші, що містять натрій нітрат, надають вогню жовтого кольору.
Калій карбонат K2CO3 — поташ, застосовують для прання білизни, пом’якшення води, миття посуду.
Кальцій карбонат CaCO3 основа крейди, яку використовують у школі для письма на дошках. Оскільки кальцій карбонат входить до складу мармуру та вапняку, його застосовують у будівництві. У хімічній промисловості з нього виготовляють вапно, а у фармацевтичній — додають до зубних паст. Кальцій карбонат використовують як білий харчовий барвник.
Хімія в нашому житті
Кухонну сіль здавна використовували наші бабусі для приготування їжі та консервування овочів. Якщо прополоскати білизну в підсоленій воді, вона не замерзатиме на морозі. А щоб позбутися неприємного запаху від леза ножа після різання цибулі, його достатньо протерти сіллю.
Замінити дорогі миючі засоби для кухні можна кальцинованою содою. Вона гарно відмиє кахель та інші поверхні. Вироби з бавовняних і лляних волокон можна також прати, додаючи у воду кальциновану соду.
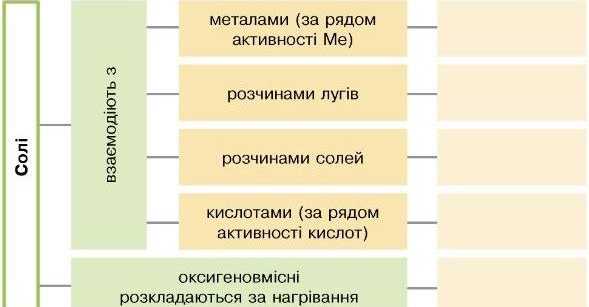
Доповніть узагальнюючу схему рівняннями реакцій. Зазначте умови перебігу цих реакцій.
Запитання та завдання
1. Перелічіть хімічні властивості солей. Зазначте умови перебігу відповідних реакцій.
2. Майже в кожному домі чи на дачі є речовини, що належать до класу солей: кухонна сіль, кальцинована сода (натрій карбонат), марганцівка (калій перманганат), крейда чи зубний порошок та інші. Опишіть їхній зовнішній вигляд та практичне використання.
3. Класифікуйте наведені речовини: барій гідроксид, літій сульфат, калій бромід, нітроген(І) оксид, силікатна кислота, ферум(ІІІ) гідроксид, цинк нітрат, магній оксид, нітратна кислота, цезій гідроксид, алюміній оксид, ортофосфатна кислота.
4. Перетворіть схеми реакцій на відповідні хімічні рівняння. Назвіть продукти реакцій:

5. Складіть рівняння можливих реакцій обміну: між сіллю і кислотою; між двома солями.
Для цього використайте речовини з переліку: арґентум нітрат, хлорид-на кислота, сульфатна кислота, калій силікат, натрій фосфат, кальцій хлорид.
6. Між якими парами речовин можлива взаємодія? Складіть рівняння реакцій і поясніть ваш вибір.
Cu і AgNO3; Sn і ZnCI2; Cr і FeCI3
7. Напишіть рівняння, за допомогою яких можна здійснити перетворення:
а) фосфор(\/) оксид —* ортофосфатна кислота —* натрій фосфат —* магній фосфат;
б) магній карбонат -» магній оксид -+ магній бромід -» магній гідроксид —* магній фосфат.
8. Щоб під час розморожування риба не втратила вологу та мінеральні речовини, її слід покласти в холодну, підсолену воду на 2-4 години (залежно від розміру). Для розморожування 1 кг риби необхідно взяти 2 л води і 1 чайну ложку кухонної солі — 5 г. Обчисліть масову частку кухонної солі в цьому розчині.
9. Для підживлення капусти використовують розчин калій хлориду з масовою часткою солі 3 %. Обчисліть, яка маса солі калій хлориду та об’єм води необхідні для приготування такого розчину масою 25 кг.
0. Обчисліть масову частку Кальцію у кальцій ортофосфаті.
1. Обчисліть масу лугу, що прореагував з магній хлоридом, якщо при цьому утворився осад кількістю речовини 0,3 моль.
2. Обчисліть об’єм газу (н. у.), що утворився під час взаємодії калій сульфіту з хлоридною кислотою масою 7,3 г.
3. Наведіть приклади солей та їх застосування.
4. Випробуйте себе у ролі журналіста: візьміть інтерв'ю у ваших родичів, знайомих про застосування різних солей у побуті. Презентуйте свою роботу у класі.
Домашній експеримент
Приготуйте вдома сік буряка. Розділіть його на три порції та випробуйте кожну окремо: лимонним соком, розчином харчової соди, мильним розчином. Прослідкуйте, як зміниться колір соку буряка від додавання різних сполук.
Як можна використати його в хімічних дослідах? Чому само?
Навчальний проект
Об’єднайтесь у групи чи пари, як пропонує вчитель, обговоріть питання, щоб з'ясувати актуальність тематики навчального проекту про вирощування кристалів солей. Придумайте назву проекту, знайдіть інформацію про техніку та методику вирощування кристалів, оберіть ту, що підходить вам. Складіть перелік необхідного для цього обладнання, список тих осіб, які можуть допомогти, розподіліть між собою обов’язки і завдання.
Обговоріть свої плани з учителем та приступайте до реалізації проекту.
Практична робота № 1
Дослідження властивостей основних класів неорганічних сполук
Обладнання та реактиви: пробірки, хімічні стакани, пробірко-тримач, нагрівальний прилад, мідні ошурки, купрум(ІІ) оксид, розчини хлоридної кислоти, натрій гідроксиду, натрій хлориду, кальцій гідроксиду, натрій карбонату, алюміній хлориду, індикаторів.
1. Повторіть правила безпеки під час роботи у кабінеті хімії.
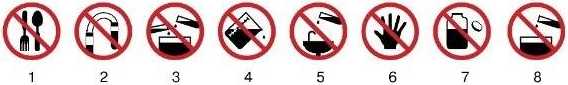
Встановіть відповідність між твердженнями та їх графічними символами:
А не їсти, не пити, не пробувати речовини на смак Б не брати речовини руками
В не виливати і не висипати залишки реактивів в банки, з яких вони взяті
Г не міняти пробки, шпателі та піпетки від різних банок Д не залишати відкритими склянки з сухими речовинами E не залишати неприбраним розсипані або розлиті реактиви Є не виливайте і не висипайте реактиви у раковину Жне зливати та не змішувати речовини без дозволу вчителя
Хід роботи:
Проводіть досліди.
1. Визначте за допомогою індикатора, у яких пробірках містяться безбарвні розчини речовин: хлоридної кислоти, натрій гідроксиду та натрій хлориду.
2. У дві пробірки помістіть окремо мідні ошурки та порошок купрум(ІІ) оксиду. Дослідіть їхню взаємодію із розчином хлоридної кислоти:
а) за звичайної температури;
б) за нагрівання.
3. До двох пробірок із розчином кальцій гідроксиду додайте окремо розчини натрій карбонату та алюміній хлориду.
Опишіть явища, що супроводжують реакції. Складіть відповідні рівняння.
Підготуйте звіт у вигляді таблиці:
|
№ |
Що робили |
Спостереження |
Рівняння реакцій та висновки |
Запишіть загальний висновок до практичної роботи, відповідаючи на запитання:
• Наскільки раціонально Ви вибрали індикатори для розрізнення запропонованих розчинів? Чому?
• Чи всі метали реагують з хлоридною кислотою?
• Які сполуки утворюються під час взаємодії основних оксидів з хлоридною кислотою?
• Як впливає нагрівання на перебіг цих реакцій?
• Які явища супроводжують реакції розчинів лугів та солей?
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 22:25, Переглядів: 11701