Структура періодичної системи елементів
Як періодична система може стати підказкою на уроках хімії?
Створену Д. І. Менделєєвим таблицю і сьогодні но-стійво доповнюють й удосконалюють.
Розглянемо будову періодичної системи.
Сучасні хіміки користуються трьома її варіантами: коротким, довгонеріодним (найбільш уживані) та розгорнутим.
Періодична система складається із неріодів, рядів, груп, підгруп. Спочатку розглянемо будову довгоиеріод-ноіч> варіанта.
Довгоііеріодннн варіант періодичної системи.
Періоди та групи
Періоди — ряди періодичної системи, що починаються з лужного елемента і закінчуються інертним елементом.
Пригадайте! Які елементи називають лужними? У якій групі вони розміщені? Які інертні гази вам відомі? У якій групі вони розміщені?
Періоди довгоііеріодного варіанта періодичної системи нумерують арабськими цифрами — їх сім. Перший, другий і третій — малі періоди, перший складається з 2-х елементів, другий і третій — з восьми. Далі великі періоди: четвертий і п’ятий містять по 18 елементів, а шостий — 32. Останній, сьомий період, також великий, але на зараз ще не завершений.
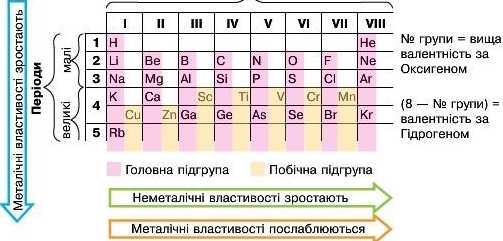
Гнутій — стовпчики періодичної системи, що об'єднують елементи з подібними властивостями сполук.
Усього в двогоперіодному варіанті груп вісім, але кожну додатково поділяють на підгрупи: головну (А) та побічну (В). Групи позначають римськими цифрами та відповідною буквою, наприклад LA, ІПБ. У одній (кожній) підгрупі елементи мають подібні властивості. Номери підгруп А відповідають значенням вищих валентностей елементів за Оксигеном. Валентність за Гідрогеном розраховують як різницю між числом 8 і номером підгрупи).
Короткий варіант періодичної системи
Короткий варіант відрізняється від довгоперіодного тим, що підгрупи у ньому не виділено окремо. Елементи однієї групи записано в один стовпчик, але їхні символи розміщено ліворуч і праворуч. Потрібно бути уважним, визначаючи підгрупи: стовпчики головних підгруп починаються вище — з першого чи другого періоду й містять елементи як малих, так і великих періодів. Побічні підгрупи починаються з 4-го періоду й містять елементи тільки великих періодів.
У головних підгрупах зі збільшенням відносної атомної маси збільшуються металічні властивості елементів і послаблюються неметалічні.
У короткому варіанті періодичної системи кожний великий період має два ряди. У малих періодах для елементів характерне різке посилення неметалічних властивостей зі зростанням атомних мас. Тому великі парні ряди містять лише металічні елементи, а непарні — починаються з металічного елемента та завершуються інертним.
У періодах зі збільшенням відносної атомної маси відбувається поступове послаблення металічних властивостей елементів і посилення неметалічних.
IIa початку XX століття завершився хімічний етап розвитку періодичної системи. Хімічна наука не могла виявити й пояснити причину періодичності властивостей елементів та їхніх сполук. Подальший розвиток періодичного закону в XX столітті пов’язаний з блискучими успіхами у фізиці, що привели до революційних змін в природознавстві.
Складіть довідничок підказок періодичної системи.
Групи
1. Скільки елементів відкрито сьогодні?
2. Назвіть елементи третього періоду. Опишіть послідовну зміну їхніх металічних і неметалічних характеристик.
3. Перелічіть окремо елементи головної та побічної підгруп III групи.
4. Скільки неметалічних елементів у другому періоді, перелічіть їх, зазначаючи групу та підгрупу.
5. Складіть формули оксидів елементів другого періоду. Як змінюється валентність цих елементів зі збільшенням відносної атомної маси?
6. Встановіть елементи за описом положення в періодичній системі:
А елемент третього періоду, другої групи
Б елемент другого періоду, п'ятої групи В елемент четвертого періоду, другої групи, головної підгрупи Г елемент п'ятого періоду, п'ятої групи, побічної підгрупи
7. Складіть таблицю за зразком і заповніть її. Встановіть положення елемента у періодичній системі.
|
Елемент |
Період, група, підгрупа |
Елемент |
Період, група, підгрупа |
|
Ті |
Cl |
||
|
Cd |
Те |
||
|
Os |
N |
8. Чому, для того щоб визначити елемент за положенням у періодичній системі, у певних випадках можна не вказувати підгрупу, а в певних — це обов’язково? Проілюструйте це прикладами.
Навчальний проект
Об'єднайтесь у групи, як пропонує учитель, обговоріть актуальність тематики навчального проекту про історію відкриття періодичної системи хімічних елементів, придумайте назву проекту, складіть план його реалізації, перелік необхідного для цього обладнання, список тих осіб, які можуть допомогти; розподіліть між собою обов’язки і завдання.
Обговоріть свої плани з учителем та приступайте до реалізації проекту.
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 21:32, Переглядів: 5624