Хімічні властивості основних, кислотних та амфотерних оксидів
Після опрацювання параграфа ви зможете:
• класифікуватиоксиди;
• наводити прикладиосновних, кислотних, амфотерних оксидів;
• характеризуватихімічні властивості основних, кислотних, амфотерних оксидів і складати відповідні рівняння реакцій;
• розрізнятинесолетворні (CO, N2O, NO, SiO) й солетворні (кислотні, основні, амфотерні) оксиди;
• установлюватигенетичний зв'язок між простими речовинами й відповідними оксидами та їхніми гідратами;
• обґрунтуватизалежність між складом, властивостями та застосуванням оксидів, оцінювати їхнє значення.
Класифікація оксидів. Ви вже вивчили хімічний склад оксидів і навчилися називати їх, ознайомилися з їхніми фізичними властивостями. А також дізналися про застосування деяких найважливіших представників цього класу неорганічних сполук. Класифікацію оксидів за їхнім складом та хімічними властивостями наведено на рис. 23.1.
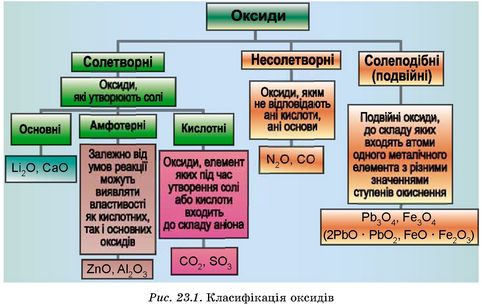
До основних оксидів належать:
• оксиди всіх металічних елементів головної підгрупи першої групи;
• оксиди всіх металічних елементів головної підгрупи другої групи, починаючи з магнію (Mg - Ra);
• оксиди металічних елементів у нижчих значеннях валентності, наприклад MnO, FeO.
Хімічні властивості основних оксидів певною мірою відомі вам з курсу хімії 7 класу. Пригадайте: ви вивчали хімічні властивості води, її взаємодію з оксидами металічних і неметалічних елементів.
Основні оксиди, утворені лужними (ІА підгрупа) і лужноземельними (ІІА підгрупа, за винятком Берилію і Магнію) металічними елементами, взаємодіють з водою. Продуктом реакції є розчинна основа - луг:
Основний оксид + вода -> луг
Наприклад, унаслідок взаємодії кальцій оксиду з водою утворюється кальцій гідроксид:
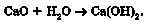
На цій реакції ґрунтується процес гасіння вапна. Взаємодія кальцій оксиду з водою відбувається дуже бурхливо, супроводжується виділенням теплової енергії (рис. 23.2). Ось як описує цей процес Іван Франко у творі «Борислав сміється»: «В вапнярках шипіло та булькотіло вапно, немов лютилось, що його наперед спражено в огні, а тепер назад вкинено у воду».

Основні оксиди взаємодіють з кислотами, утворюючи сіль і воду:
Основний оксид + кислота —> сіль + вода
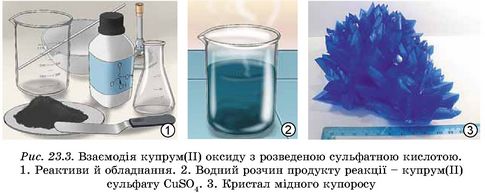
Чорний порошок купрум(ІІ) оксиду CuO помістимо в хімічний стакан. Доллємо трохи розведеної сульфатної кислоти. Для початку реакції одного контактування речовин недостатньо, потрібне нагрівання. Злегка нагріємо стакан з речовинами, не доводячи розчин до кипіння. У результаті реакції чорний порошок купрум(ІІ) оксиду поступово зникає. Утворюється розчин блакитного кольору (рис. 23.3):
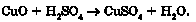
Ця реакція належить до реакцій обміну.
Реакція обміну — це реакція між двома складними речовинами, у результаті якої вони обмінюються своїми складовими частинами. Продукти реакції — дві нові складні речовини.
Основні оксиди можуть взаємодіяти з кислотними і амфотерними оксидами, утворюючи солі:
Основний оксид + кислотний оксид —> сіль
Наприклад, унаслідок взаємодії кальцій оксиду з карбон(ІУ) оксидом утворюється кальцій карбонат:
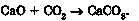
Кислотними оксидами є більшість оксидів неметалічних елементів (SO3, P2O5 тощо). Вищі оксиди металічних елементів зі змінною валентністю також виявляють переважно кислотні властивості, наприклад: CrO3, Mn2O7, V2O5. Зв’язок між хімічними елементами, їхніми кислотними оксидами та гідратами оксидів зображено на рисунку 23.4.

Хімічні властивості кислотних оксидів. Вам уже відомо, що кислотні оксиди можуть взаємодіяти з водою, утворюючи кислоти:
Кислотний оксид + вода -> кислота
Так, продуктом реакції сульфур^І) оксиду з водою є сульфатна кислота:
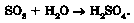
Унаслідок взаємодії фосфор(У) оксиду з водою утворюється ортофос-фатна кислота (рис. 23.5):
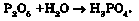

Зверніть увагу: силіцій(ІУ) оксид SiO2 з водою не реагує!
Перетворіть схему реакції фосфор(У) оксиду з водою на хімічне рівняння. До якого типу належать реакції оксидів з водою?
Кислотні оксиди взаємодіють з лугами. Продуктами реакції є сіль і вода:
Кислотний оксид + луг —> сіль + вода
Наприклад, унаслідок взаємодії сульфур(ІУ) оксиду з натрій гідроксидом утворюється натрій сульфіт і вода:
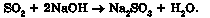
3. Кислотні оксиди можуть реагувати з основними оксидами, утворюючи солі:
Кислотний оксид + основний оксид -» сіль
Приміром, продуктом взаємодії карбон(ІУ) оксиду з барій оксидом є барій карбонат:
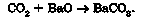
Щоб скласти рівняння цієї реакції, потрібно виконати такі дії:
1) визначити за формулою кислотного оксиду хімічну формулу відповідної йому кислоти, формулу кислотного залишку і його валентність;
2) визначити за формулою основного оксиду валентність металічного елемента;
3) скласти за валентністю формулу солі;
4) записати схему реакції і перетворити її на хімічне рівняння.
Хімічні властивості амфотерних оксидів. Амфотерні оксиди під час
взаємодії з кислотою або кислотним оксидом виявляють властивості, характерні для основних оксидів. Так само, як основні оксиди, вони взаємодіють з кислотами з утворенням солі і води. У результаті реакції цинк оксиду із сульфатною кислотою утворюються цинк сульфат ZnSO4 і вода:
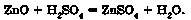
Амфотерні оксиди виявляють кислотні властивості в реакціях з лугами або з оксидами лужних і лужноземельних елементів. Унаслідок стоп-лення амфотерних оксидів з лугами утворюються сіль і вода.
Продуктами стоплення цинк оксиду з калій гідроксидом є калій цинкат і вода:
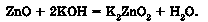
Унаслідок стоплення амфотерного й основного оксидів утворюється сіль. Якщо алюміній оксид стопити з кальцій оксидом, утвориться кальцій алюмінат:
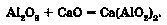
Зверніть увагу: якщо металічний елемент виявляє кілька ступенів окиснення, то його оксид з нижчим ступенем окиснення виявлятиме, зазвичай, основні властивості, з вищою - кислотні, а з проміжною - амфо-
+2 -2 +3 -2
терні. Наприклад, хром(ІІ) оксид CrO - основний, хром(ІІІ) оксид Cr2O3 -
+6 -2
амфотерний, хром(УІ) оксид CrO3 - кислотний.
ПРО ГОЛОВНЕ
• Найважливіші групи оксидів - основні, кислотні, амфотерні оксиди.
• У результаті реакцій кислотних оксидів з водою утворюються кислоти, а продуктами гідратації оксидів найбільш активних металічних елементів (Li, Na, K, Mg, Ca, Sr, Ba тощо) є луги.
• Продуктами реакції основних і кислотних оксидів між собою є солі.
• Основні оксиди взаємодіють з кислотами.
• Кислотні оксиди реагують з лугами.
• Амфотерні оксиди виявляють як основні, так і кислотні властивості.
• У реакції обміну реагенти - дві складні речовини. Під час перебігу реакції вони обмінюються складовими частинами. Продуктами реакції обміну є дві нові складні речовини.
Перевірте себе
1. На які групи класифікують оксиди? 2. Які оксиди називають основними? Кислотними? Амфотерними?
Застосуйте свої знання й уміння
1. Класифікуйте оксиди FeO, SO3, Na2O, CO2, N2O5, BaO, P2O5, SO2, Na2O, K2O, MnO.
2. Наведіть по два приклади основних, кислотних і амфотерних оксидів.
3. Назвіть найважливіші індикатори.
4. Схарактеризуйте хімічні властивості основних оксидів на прикладі літій оксиду.
5. Схарактеризуйте хімічні властивості кислотних оксидів на прикладі сульфур(УІ) оксиду.
6. Оксид одного з хімічних елементів реагує з водою. У водному розчині продукту реакції фенолфталеїн набуває малинового забарвлення. Класифікуйте оксид. Поясніть, до якого класу неорганічних сполук належить продукт його гідратації.
7. Оксид одного з хімічних елементів реагує з водою. У водному розчині продукту реакції метиловий оранжевий набуває рожевого забарвлення. Класифікуйте оксид. Поясніть, до якого класу неорганічних сполук належить продукт його гідратації.
8. Відтворіть хімічні рівняння за наведеними фрагментами, визначте, які з них відповідають реакціям обміну: а) SO3 + ... = Na2SO4 + H2O; б) ... + H2O = Ba(OH)2; в) SiO2 + + ... = CaSiO3; г) CrO3 + ... = H2CrO4; д) ... + FeO = FeSO4 + H2O; е) HBr + ... = CaBr2 + H2O.
9. Складіть хімічні формули гідратів, які відповідають оксидам Калію, Магнію, Селену(ІУ), Хлору(УІІ).
10*. 2004 року в ЗМІ з'явилося повідомлення: «Наука приходить на допомогу кулінарії: винайдено упаковку, яка після відкорковування здатна розігріти харчі до потрібної температури. Між стінками бляшанки у двох окремих контейнерах містяться

кальцій оксид і вода (рис. 23.6). Щойно бляшанку відкорковують - два реагенти змішуються й харчі нагріваються». Оцініть вірогідність цієї інформації, обґрунтуйте свою думку.
1І*. Для ліквідації шаруватих хмар застосовують сухий лід. Його розпорошують з висоти кількох тисяч метрів. Потрапляючи до хмар, частинки реагенту концентрують вологу навколо себе, «витягаючи» з хмар воду. У результаті практично відразу починається рясний дощ. Складіть рівняння реакції, яка відбувається під час перебігу описаного процесу. Спрогнозуйте забарвлення універсального індикаторного папірця в цій дощовій воді.
12*. Чи не найдавніший метод фарбування в білий колір - побілка. Цей простий і доступний прийом декоративної обробки крізь віки дійшов до наших днів. Не оминули його увагою й письменники. Марк Твен описав кумедну історію з побілкою паркану: «Том вийшов... із цебром вапна й довгим пензлем... Зітхнувши, він умочив у вапно пензель, провів ним по верхній дошці, потім проробив те саме знову й зупинився: як мізерно виглядала біла смужка порівняно з величезним простором нефарбованого паркану!»
З наведеного опису випливає, що для побілки використовували суміш гашеного вапна з водою. Така фарба із часом стає ще міцнішою, бо перетворюється на крейду. Пригадайте, який кислотний оксид міститься в повітрі, й складіть рівняння відповідної реакції.
13. «Увага! Негашене вапно необхідно зберігати в закритій тарі, захищеній від доступу вологи. Негашене вапно зберігати не більше 30 діб, тому що під час доступу повітря воно втрачає активність». Поясніть це застереження з інструкції щодо використання негашеного вапна. Складіть рівняння відповідних реакцій.
14. Обчисліть і порівняйте масові частки хімічних елементів у кислотних оксидах, формули яких наведено на рис. 23.1.
15. Обчисліть маси (г) основних оксидів, формули яких наведено на рис. 23.1, узятих кількістю речовини 0,5 моль.
16. Обчисліть кількість молекул та масу (г) одного з несолетворних оксидів, формули яких наведено на рис. 23.1, кількістю речовини 0,25 моль.
17. Обчисліть масу (г) кальцій карбонату, який утвориться внаслідок взаємодії кальцій оксиду масою 112 г з карбон(ІУ) оксидом.
18. Обчисліть об'єм (л) сульфур(ІУ) оксиду (н. у.), який прореагував з водою, якщо в результаті утворилася сульфітна кислота масою 164 г.
Творча майстерня
Складіть сенкан на тему «Оксиди».
Це матеріал з підручника Хімія 8 клас Лашевська
Автор: admin от 21-10-2016, 03:11, Переглядів: 7420