§ 68. Хімічні властивості солей: взаємодія з кислотами та між собою
У цьому параграфі ви дізнаєтеся:
• як солі взаємодіють із кислотами;
• у якому випадку в результаті зливання розчинів двох солей утворюються нові солі;
• як солі розкладаються під час нагрівання.
Взаємодія солей із кислотами. У реакцію з кислотами можуть вступати як розчинні, так і нерозчинні солі, наприклад:
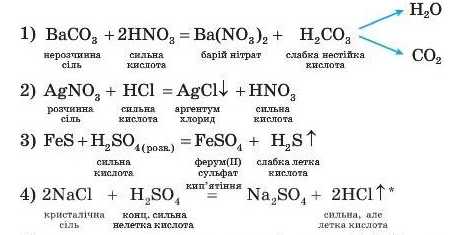
Як видно з наведених прикладів, реакції відбуваються, якщо внаслідок їх утворюється важкорозчинна сіль (приклад 2), летка кислота (приклади 3, 4) або нестійка слабка кислота (приклад 1).
За умови цієї реакції HCl газувата речовина, бо реакцію проводять у процесі кип’ятіння.
Демонстраційний дослід
Проведемо реакцію обміну між натрій карбонатом і хлорид-ною кислотою. Приллємо до розчину натрій карбонату хло-ридну кислоту. Спостерігаємо виділення газу. Результатом реакції є нова розчинна сіль і нова кислота:
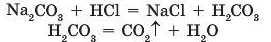
Отже, виділяється вуглекислий газ.
Але деякі нерозчинні солі не вступають із кислотами в реакції обміну. Це означає, що такі солі не розчиняються ані у воді, ані в розведених кислотах за звичайних умов. Приклади цих солей — AgCl, AgI, CuS, Ag2S.
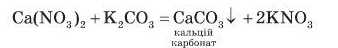
Взаємодія солей між собою. Солі взаємодіють між собою з утворенням двох нових солей, якщо хоча б одна з нових солей є важкорозчинною. У реакцію обміну вступають тільки розчинні солі:
У досить рідких випадках обидві солі, що утворюються, є важко розчинними:
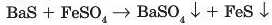
Лабораторний дослід 12
Реакції обміну між солями у водному розчині
Змішайте рівні об’єми (по 10 см3) розчинів натрій сульфату й барій хлориду. Що спостерігаєте? Який склад осаду, що утворився? Якого він кольору? Яка сіль утворилася в розчині? Запишіть спостереження в зошит. Повторіть дослід з аргентум(І) нітратом і натрій хлоридом. Складіть рівняння реакцій. Зробіть висновок щодо умов, за яких відбуваються реакції обміну між солями.
Термічне розкладання солей. Деякі солі розкладаються в результаті нагрівання. Ця властивість характерна як для середніх, так і для кислих та основних солей:
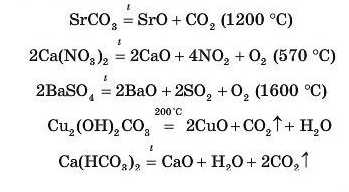
З наведених рівнянь видно, що продуктами розкладання солей найчастіше є оксиди, утворені металічними й иеметалічии-ми елементами.
І Запитання та завдання
° 1. У реакцію з кислотами можуть вступати: а) тільки розчинні у воді солі; б) тільки нерозчинні у воді солі; в) як розчинні, так і нерозчинні солі. Наведіть приклади.
; 2. Якщо продуктом взаємодії солі з кислотою є нова сіль, то вона має бути нерозчинною: а) тільки у воді; б) як у воді, так і в кислотах. Наведіть приклади.
° 3. Обов’язковою умовою взаємодії двох розчинних солей є:
а) хоча б одна з утворених солей має бути нерозчинною;
б) обидві утворені солі мають бути нерозчинними; в) не має значення. Наведіть приклади.
4. Складіть рівняння реакцій, що відповідають таким перетворенням:
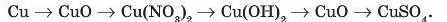
5. З якими з перелічених речовин прореагує розчин плюмбум(Н) нітрату: цинк хлорид, залізо, натрій гідроксид, сульфур(ІУ) оксид, купрум(ІІ) сульфат, сульфатна кислота, ферум(ІІ) оксид, бромідпа кислота?
6. Які з реакцій можуть відбутися:
a) BaCl2 + H2SO1; б) Pb(NO3)2 + НІ; в) KNO3 + HCl?
7. Для повного розчинення ферум(ІІ) оксиду кількістю речовини 0,1 моль необхідно 9,8 г сульфатної кислоти. Визначте масу ферум(ІІ) сульфату в утвореному розчині.
8. Напишіть рівняння реакцій металів з кислотами, у результаті яких утворюються: а) кальцій хлорид; б) магній дигідрогенортофосфат; в) станум(Н) сульфат.
9. У двох посудинах без етикеток містяться дистильована вода й розчин кухонної солі. Перелічіть способи, за допомогою яких можна визначити, що за речовина міститься в кожній із посудин.
10. Залізний купорос являє собою ферум(ІІ) сульфат гептагі-драт FeSO1 • 7ГІ20, а мідний купорос — купрум(ІІ) сульфат пептагідрат CuSO1 • 5Н20. Як можна одержати залізний купорос із мідного купоросу?
Експериментуємо вдома Яйце опустіть у банку з розчином оцтової кислоти. Поясніть, що відбувається, зважаючи па те, що шкаралупа складається в основному із солі CaCO3.
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:52, Переглядів: 6337