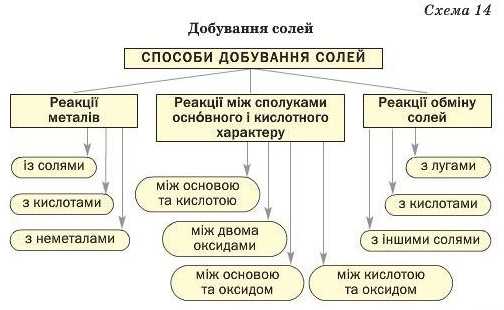
Способи добування солей
Матеріал параграфа допоможе вам:
• засвоїти найважливіші способи добування солей;
• обирати реакції для добування певної солі й умови, необхідні для їх здійснення.
Солі можна добути значно більшою кількістю способів, ніж оксиди, основи чи кислоти.
Реакції за участю металів
Спосіб 1: метал + неметал —» сіль.
Цим способом можна добувати безоксигенові солі:
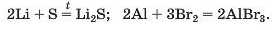
Спосіб 2: метал + кислота (розчин) -» сіль + водень.
У такі реакції вступають сульфатна (у розбавленому розчині), хлоридна, деякі інші кислоти і метали, які перебувають у ряду активності зліва від водню:
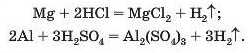
Спосіб 3: метал + луг -» сіль + водень.
Із лугами та їхніми розчинами реагують метали, які походять від елементів, що утворюють амфотерні оксиди і гідроксиди:
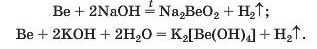
Спосіб 4: метал 1 + сіль 1 (у розчині) —• метал 2 + сіль 2.
Вам відомо, що така реакція є можливою, якщо метал 1 активніший за метал 2, тобто метал 1 розміщений у ряду активності зліва від металу 2:
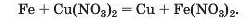
Реакції між сполуками з основними та кислотними властивостями
Спосіб 5: основа (амфотерний гідроксид) + кислота (амфотерний гідроксид) —» сіль + вода1 (мал. 73):
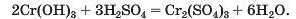
Спосіб 6: основний (амфотерний) оксид + кислотний (амфотерний) оксид —» сіль1:
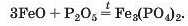
Спосіб 7: основа + кислотний (амфотерний) оксид —» сіль + вода:
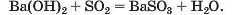
Спосіб 8: кислота 4- основний (амфотерний) оксид —• сіль + вода:
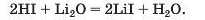
Способи 6 і 7 непридатні для добування солей безоксигенових кислот, оскільки ці кислоти не мають кислотних оксидів.

‘Амфотерні сполуки не взаємодіють одна з одною.
Реакції обміну за участю солей
Спосіб і): сіль 1 + кислота 1 —» сіль 2 + кислота 2:
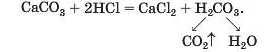
Спосіб 10: сіль 1 + луг —• сіль 2 + основа:
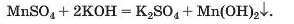
Спосіб 11: сіль 1 + сіль 2 —• сіль 3 + сіль 4 (мал. 74):
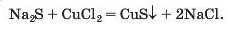
Цікаво знати
Солі Al2(CO3)3, FeI3 та деякі інші до цього часу не добуто.

Обираючи способи 9—11, зважають на те, що реакція обміну можлива в разі утворення осаду, газу або слабкої кислоти.
Викладений матеріал узагальнює схема 14.
ВПРАВА. Запропонувати якнайбільше способів добування магній сульфату MgSO4.
Розв'язання
Магній сульфат — оксигеновмісна сіль, тому спосіб 1 для добування сполуки не підходить.
Цю сіль можна добути, взявши за вихідну речовину метал (способи 2 і 4) і врахувавши його розміщення в ряду активності:
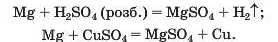
Магній сульфат може утворитися в результаті реакцій між відповідними речовинами основного та кислотного характеру (способи 5—8):
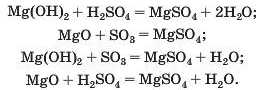
Для реакції солі з кислотою (спосіб 9) потрібно взяти сіль Магнію, утворену слабкою чи леткою кислотою або кислотою, здат-ною розкладатися з виділенням газу, і сульфатну кислоту:
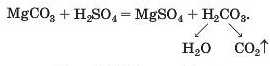
Реакція солі з лугом (спосіб 10) для добування магній сульфату не підходить, оскільки гідроксид Mg(OH)2 є не лугом, а малорозчинною основою.
Магній сульфат розчиняється у воді. Зваживши на це, оберемо для реакції між двома солями (спосіб 11) такі реагенти:
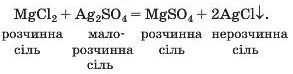
ЛАБОРАТОРНИЙ ДОСЛІД № 9 Розв’язування експериментальних задач
Варіант 1. У вашому розпорядженні — розбавлена хлоридна кислота, розчини цинк сульфату і натрій
'ідроксиду. Згідно із запропонованою схемою перетво-їєнь здійсніть реакції 1—4:

Варіант 2. У вашому розпорядженні — розбавлена нітратна кислота, розчини алюміній хлориду і натрій гідроксиду. Згідно із запропонованою схемою перетворень здійсніть реакції 1 —4:

При виконанні експерименту розчин кожного реагенту додавайте по краплях до завершення відповідної реакції.
Запишіть у зошит схему перетворень із хімічними формулами сполук, спостереження і рівняння здійснених реакцій.
Солі добувають кількома способами. Частина способів ґрунтується на реакціях металів із неме талами, кислотами, лугами, солями. Інші спосо би передбачають здійснення реакцій між сполу камн з основними та кислотними властивостями а також реакцій обміну за участю солей.
286. Сіль якого типу можна добути за реакцією між простими речовинами? Запишіть кілька відповідних хімічних рівнянь.
287. Запропонуйте якомога більше способів добування:
а) цинк хлориду: в) барій карбонату.
б) купрум(ІІ) сульфату:
Напишіть рівняння реакцій.
288. Як із натрій сульфату добути натрій хлорид? Як здійснити протилежне перетворення? Наведіть хімічні рівняння й укажіть умови, за яких відбуваються реакції.
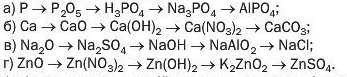
290. Доберіть речовини для здійснення перетворень і напишіть відповідні хімічні рівняння:
289. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі послідовні перетворення:
а) амфотерний гідроксид (як основа) -» сіль;
б) амфотерний гідроксид (як кислота) -• сіль;
в) сіль 1 сіль 2 -» сіль 3 (усі солі утворені одним і тим самим металічним елементом).
291. Як добути алюміній хлорид, використовуючи літій оксид, алюміній нітрат, воду і хлоридну кислоту? Складіть відповідні хімічні рівняння і вкажіть умови, за яких відбуваються реакції.
292. Чи можна добути алюміній хлорид, якщо у вашому розпорядженні є лише алюміній сульфат і хлоридна кислота? Відповідь поясніть.
293. Яку масу калій сульфату можна добути за реакцією 14 г калій гідроксиду з необхідною кількістю сульфатної кислоти?
294. У результаті взаємодії 14,6 г суміші цинку і цинк оксиду з достатньою кількістю хлоридної кислоти виділилося 2,24 л водню (н. у.). Яка маса солі утворилася?
295. При нагріванні 46,8 г суміші карбонатів Кальцію і Магнію з достатньою кількістю силіцій(ІУ) оксиду виділилося 11,2 л газу (н. у.). Обчисліть масові частки силікатів у добутій їхній суміші.
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:58, Переглядів: 11412