Сучасна модель атома
Матеріал параграфа допоможе вам:
• зрозуміти, що таке орбіталь, енергетичний рівень і підрівень;
• з’ясувати форми і розміщення орбіталей у просторі;
Цікаво знати
Електрон не вдається побачити навіть у
найпотужніший
мікроскоп.
• визначати максимальну кількість електронів на енергетичному рівні та підрівні.
Електронні орбіталі. Результати досліджень електронів свідчать про те, що ці частинки відрізняються від звичайних фізичних тіл. Точно визначити траєкторію руху електрона, його координати у просторі неможливо. Він може перебувати в будь-якій точці атома (мал. 14).
Частину простору в атомі, де перебуванші електрона найімовірніше, називають орбіталлю.
Орбіталь із електроном схожа на мікроскопічну хмару (існує термін «електронна хмара»). У ній розподілені і маса, і заряд електрона.
Орбіталі можуть мати кілька форм3. Найпростіша серед них — сферична (мал. 15), тобто
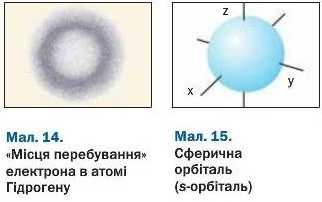
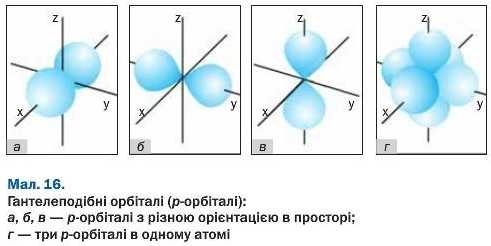
форма кулі (в її центрі розміщене ядро атома). Таку орбіталь позначають літерою s, а електрон у ній називають s-електроном. Другий різновид форми — гантелеподібна (мал. 16). Її має р-ор-біталь. Такі орбіталі розміщені в просторі вздовж осей X, у, z; тому їх ще називають рх~, Py-, р,-орбіталями. У них перебувають р-елек-трони. Існують ще d- і f-орбіталі, які мають складніші форми.

У кожній орбіталі може перебувати один або два електрони. Ці два електрони різняться між собою за ознакою, яку називають спіном\ Її спрощено подають як обертання електрона навколо власної осі (так обертається наша планета, унаслідок чого відбувається зміна дня і ночі). Один з електронів обертається навколо цієї осі за годинниковою стрілкою, інший — проти неї, тобто має протилежний спін (мал. 17). Ці електрони позначають в орбіталі протилежно спрямованими стрілками:
1 Термін походить від англійського слова spin — обертатися.

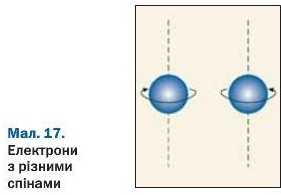
Орбіталь, у якій містяться два електрони, є заповненою. Якщо в орбіталі один електрон, то його називають неспареним, а якщо два — спареними.
Енергетичні рівні. Найважливішою характеристикою електрона, яку можна визначити досить точно, є його енергія. Електрони, що займають в атомі одну чи кілька орбіталей однакової форми і розміру, мають однакову енергію.
Чим компактніша орбіталь і чим ближче до ядра перебуває електрон, тим його енергія менша.
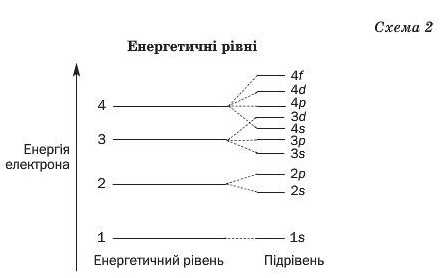
Сучасна модель атома враховує енергію електронів. У цій моделі електрони розподіляють за так званими енергетичними рівнями (схема 2). Кожний енергетичний рівень заповнюють електронами з однаковою чи близькою енергією. Електрони першого рівня мають найменшу енергію; вони перебувають найближче до ядра атома. Другий рівень займають електрони з вищою енергією, третій — зі ще вищою і т. д.
Замість терміна «енергетичний рівень» нерідко використовують інший — «електронна оболонка».
Енергетичні рівні складаються з підрівнів, причому номер рівня вказує на кількість підрівнів. Так, у першого рівня є один підрі-вень, у другого — два, у третього — три, у четвертого — чотири і т. д. (схема 2).
Розподіл електронів за енергетичними рівнями. Кожний енергетичний рівень вміщує обмежену кількість електронів. їх максимальну кількість визначають за формулою
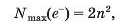
де п — номер рівня.
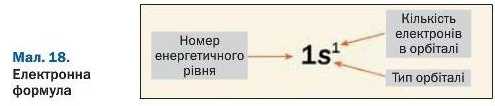
На першому енергетичному рівні може перебувати не більше 2 · 1“ = 2 електронів. Вони розміщуються в одній орбіталі (сферичній), є s-електронами, мають одну й ту саму енергію, але різняться своїми спінами.
Заповнення електронами першого енергетичного рівня проілюструємо так званими електронними формулами (мал. 18) та їх графічними варіантами:

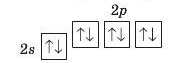
Другий енергетичний рівень може вмістити максимум 2 · 2~ = 8 електронів. Два з них займають одну s-орбіталь, але більшого об’єму, ніж та.
що належить першому рівню. Вони також мають протилежні спіни. Решта (шість) електронів другого рівня є р-електронами. Оскільки в кожній орбіталі може перебувати не більше двох електронів, то р-орбіталей повинно бути 6:2 = 3. Це орбіталі одного енергетичного рівня; вони мають однаковий об’єм і розміщені вздовж осей координат (мал. 16).
Електронна формула заповненого другого енергетичного рівня —
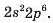
Цікаво знати
Електрони починають надходити у 3</-орбіталі після
заповнення
4в-орбіталі.
Сферична орбіталь для електрона вигідніша за гантелеподібну. Тому s-електрони другого енергетичного рівня мають трохи нижчу енергію, ніж р-електрони. Це можна показати у графічному варіанті електронної формули, розмістивши р-орбіталі вище, ніж s-орбіталі:
Отже, другий енергетичний рівень складається з двох підрівнів. Ix позначають так само, як і відповідні електрони: 28-підрівень, 2р-підрівень (схема 2).
Третій енергетичний рівень уміщує не більше 2 · З2 = 18 електронів. На ньому є три підрів-ні — 3s, Зр і 3d. Якщо на s-підрівні може бути не більше 2-х електронів, на р-підрівні — не більше 6-ти, то максимальна кількість електронів на (і-підрівні становить 18 - 2 - 6 = 10. Це — d-електрони; вони займають п’ять орбіталей.
► Запишіть електронну формулу та її графічний варіант для третього енергетичного рівня, повністю заповненого електронами.
Сучасна модель атома дає змогу відтворити його електронну будову, визначати можливості сполучення атома з іншими атомами, а також втрати атомом електронів чи їх приєднання. Усе це зумовлює хімічні властивості простих і складних речовин.
Частину простору в атомі, де перебування електрона найімовірніше, називають орбітал-лю. Орбіталі мають кілька форм — сферичну (у такій орбіталі містяться s-електрони), гантеле-подібну (5' ній перебувають р-електрони) та деякі інші. Орбіталь може містити один або два електрони.
Властивість електрона, яка нагадує обертання навколо власної осі, називають спіном.
У сучасній моделі атома електрони розподіляють за енергетичними рівнями та підрівня-ми. Кожний рівень і підрівень вміщує обмежену кількість електронів.
38. Що таке орбіталь? Які форми мають S- і р-орбіталі?
39. Як розміщені у просторі р-орбіталі одного атома? Чому в позначенні s-орбіталі немає індексу (наприклад, s,)?
40. Знайдіть відповідність:
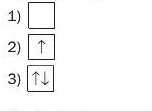 |
а) заповнена орбіталь; б) спарені електрони; в) електрони з протилежними спінами; г) неспарений електрон; г) порожня (вакантна) орбіталь. |
41. Назвіть характеристики, за якими один електрон може відрізнятися від іншого чи бути подібним до нього.
42. Енергія якої частинки менша: s-електрона на 1-му енергетичному рівні чи р-електрона на 2-му енергетичному рівні? Відповідь поясніть.
43. Чи завжди енергія електрона 3-го енергетичного рівня більша, ніж електрона 2-го рівня? Чи зміниться відповідь, якщо порівнювати енергію електрона 4-го рівня і електрона 3-го рівня? Використайте схему 2.
44. Який запис дає більше інформації про електрони: електронна формула чи її графічний варіант? Чому?
45. Серед указаних підрівнів назвіть ті, які в атомі неможливі: 6р, 2d, lp, 5s.
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:41, Переглядів: 4849